Окрашивает пламя в яркий желто оранжевый цвет. Металлы главных подгрупп
Пламя бывает разного цвета. Посмотрите в камин. На поленьях пляшут желтые, оранжевые, красные, белые и синие языки пламени. Его цвет зависит от температуры горения и от горючего материала. Чтобы наглядно себе это представить, вообразите спираль электрической плитки. Если плитка выключена - витки спирали холодные и черные. Допустим, вы решили подогреть суп и включили плитку. Сначала спираль становится темно-красной. Чем выше поднимается температура, тем ярче красный цвет спирали. Когда плитка разогревается до максимальной температуры, спираль становится оранжево-красной.
Естественно, спираль не горит. Вы же не видите пламени. Она просто очень горячая. Если нагревать ее дальше, то будет меняться и цвет. Сначала цвет спирали станет желтым, затем белым, а когда она раскалится еще больше, от нее будет исходить голубое сияние.
От чего зависит цвет пламени
Нечто подобное происходит и с пламенем. Возьмем для примера свечу. Различные участки пламени свечи имеют разную температуру. Огню нужен кислород. Если свечу накрыть стеклянной банкой, огонь погаснет. Центральный, прилегающий к фитилю участок пламени свечи, потребляет мало кислорода, и выглядит темным. Верхушке и боковым участкам пламени достается больше кислорода, поэтому эти участки ярче.
По мере того как пламя продвигается по фитилю, воск тает и потрескивает, рассыпаясь на мельчайшие частички углерода. (Каменный уголь тоже состоит из углерода.) Эти частички увлекаются пламенем кверху и сгорают. Они очень горячие и светятся, как спираль вашей плитки. Но частички углерода намного горячее, чем спираль самой жаркой плитки (температура сгорания углерода примерно 1 400 градусов Цельсия). Поэтому свечение их имеет желтый цвет. Около горящего фитиля пламя еще горячее и светится синим цветом.
Пламя камина или костра в основном пестрого вида. Дерево горит при более низкой температуре, чем фитиль свечи, поэтому основной цвет костра - оранжевый, а не желтый. Некоторые частички углерода в пламени костра имеют довольно высокую температуру. Их немного, но они добавляют пламени желтоватый оттенок. Остывшие частички раскаленного углерода - это копоть, которая оседает на печных трубах. Температура горения дерева ниже температуры горения свечи. Кальций, натрий и медь, нагретые до высокой температуры, светятся разными цветами. Их добавляют в порох ракет для расцвечивания огней праздничных фейерверков.
Цвет пламени и химический состав
Цвет пламени может меняться в зависимости от химических примесей, содержащихся в поленьях или другом горючем веществе. В пламени может находиться, например, примесь натрия. Натрий - это составная часть поваренной соли. Если натрий раскалить, он окрашивается в ярко - желтый цвет. В огонь может попасть кальций.
Мы все знаем, что кальция много в молоке. Это металл. Раскаленный кальций окрашивается в яркий красный цвет. Если в огне горит фосфор, то пламя окрасится в зеленоватый цвет. Все эти элементы или содержатся в дереве, или попадают в огонь с другими веществами. Смешение цветов пламени, как и смешение цветов радуги, может дать белый цвет, поэтому в пламени костра или камина видны белые участки.
GD Star Rating
a WordPress rating system
Качественный анализ катионов
Na +
Реакция окрашивания пламени
Чистую накалённую проволоку опустите в раствор хлорида натрия или наберите на неё немного твёрдой соли . Внесите проволоку вместе с капельками или частицами натриевой соли в бесцветное пламя горелки – пламя окрасится в жёлтый цвет.
K +
Реакция окрашивания пламени
Летучие соединения калия окрашивают бесцветное пламя в характерный фиолетовый цвет . Фиолетовая окраска пламени в присутствии солей натрия становится незаметной, так как соединения натрия окрашивают пламя горелки в жёлтый цвет.
Реакции с гексанитрокобальтатом
(ΙΙΙ) натрия

Поместите в пробирку 1-2 капли раствора
какой-либо соли калия, прибавьте к нему
3-5 капель раствора гексанитрокобальтата
(ΙΙΙ) натрия, добавьте несколько капель
6 М уксусной кислоты и потрите стеклянной
палочкой о стенки пробирки. При этом
выпадет жёлтый кристаллический осадок
гексанитрокобальтата (ΙΙΙ) дикалия-натрия
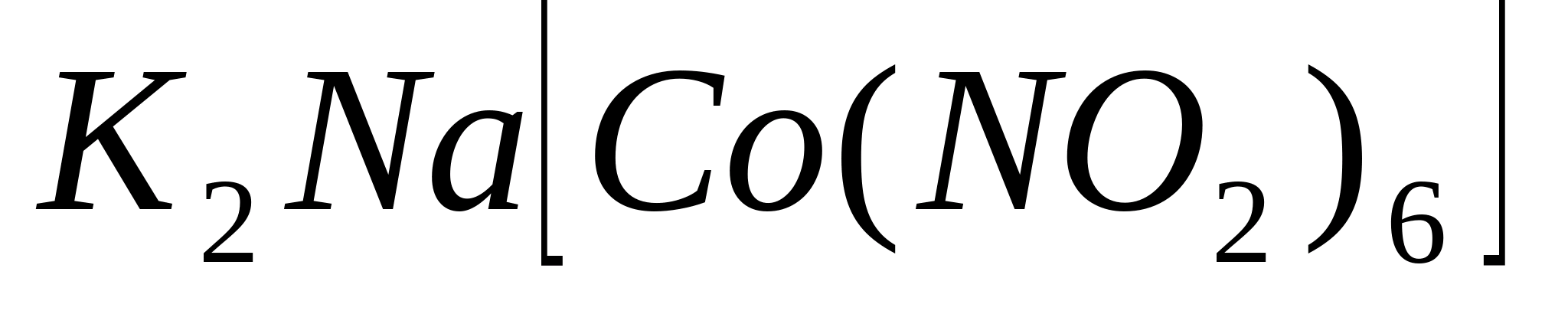 :
:
или в ионной форме:
Реакцию следует проводить в присутствии разбавленной уксусной кислоты.
Реакция
с гидротартратом натрия

Поместите в пробирку 2-3 капли раствора какой-либо соли калия, прибавьте 0,5 мл раствора гидротартрата натрия и потрите стеклянной палочкой о стенки пробирки. Через некоторое время выпадет белый кристаллический осадок:
или в ионной форме:
Условия проведения реакции.
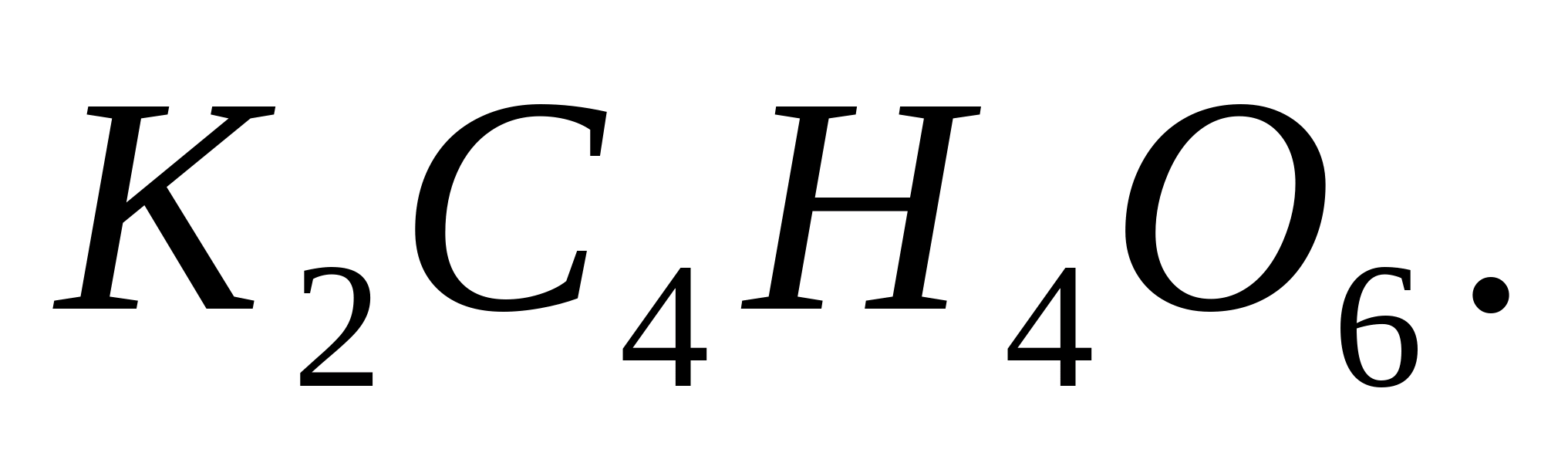
NH 4 +
Реакция
с реактивом Несслера

Прибавьте
к капле
разбавленного раствора соли
аммония 1-2 капли раствора реактива. В
присутствии
 -
ионов образуется характерный
красно-бурый осадок; при наличии следов
раствор окрашивается в жёлтый цвет:
-
ионов образуется характерный
красно-бурый осадок; при наличии следов
раствор окрашивается в жёлтый цвет:
или в ионной форме:
Другие катионы Ι аналитической группы не мешают обнаружению ионов аммония реактивом Несслера.
Реакция со щелочами
Поместите в пробирку несколько капель
раствора соли аммония
 и добавьте 5 капель водного раствора
какого-либо из сильных оснований -
и добавьте 5 капель водного раствора
какого-либо из сильных оснований -
 -
и подогрейте содержимое пробирки в
пламени газовой горелки. Вследствие
разложения соли аммония выделится
аммиак
:
-
и подогрейте содержимое пробирки в
пламени газовой горелки. Вследствие
разложения соли аммония выделится
аммиак
:
или в ионной форме:
Выделяющийся аммиак может быть обнаружен различными способами:
по запаху;
по посинению универсальной индикаторной бумаги, смоченной дистиллированной водой и внесённой в пары над раствором;
по образованию дыма хлорида аммония при поднесении к отверстию пробирки стеклянной палочки, смоченной каплей концентрированной хлороводородной (соляной) кислоты.
Кипячение с едкими щелочами или карбонатами натрия или калия
При действии едких щелочей или карбонатов натрия или калия, а также при длительном нагревании аммониевые соли в растворах разлагаются с выделением газообразного аммиака.
Mg ++
Действие сильных оснований.
При добавлении сильных оснований к
растворам солей магния выпадает белый
осадок
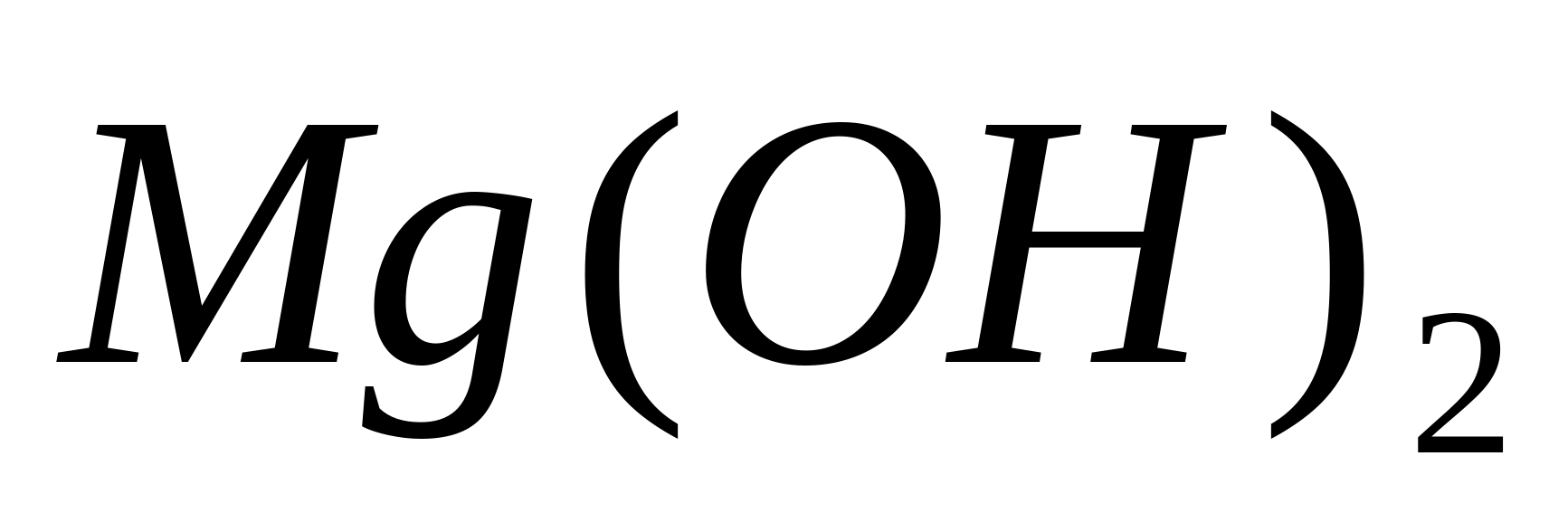 .
При добавлении слабого основания
(гидроксида аммония) осаждение
неполное,
а в присутствии солей аммония осадок
не выпадает совсем. Поэтому соли аммония
нужно предварительно удалить из раствора.
.
При добавлении слабого основания
(гидроксида аммония) осаждение
неполное,
а в присутствии солей аммония осадок
не выпадает совсем. Поэтому соли аммония
нужно предварительно удалить из раствора.
Поместите в пробирку несколько капель
раствора MgCl
2
,
добавьте несколько капель водного
раствора какого-либо из сильных оснований
-
.
Выпадет осадок Mg
(ОН)
2
.
В другую пробирку к раствору MgCl
2
вместо
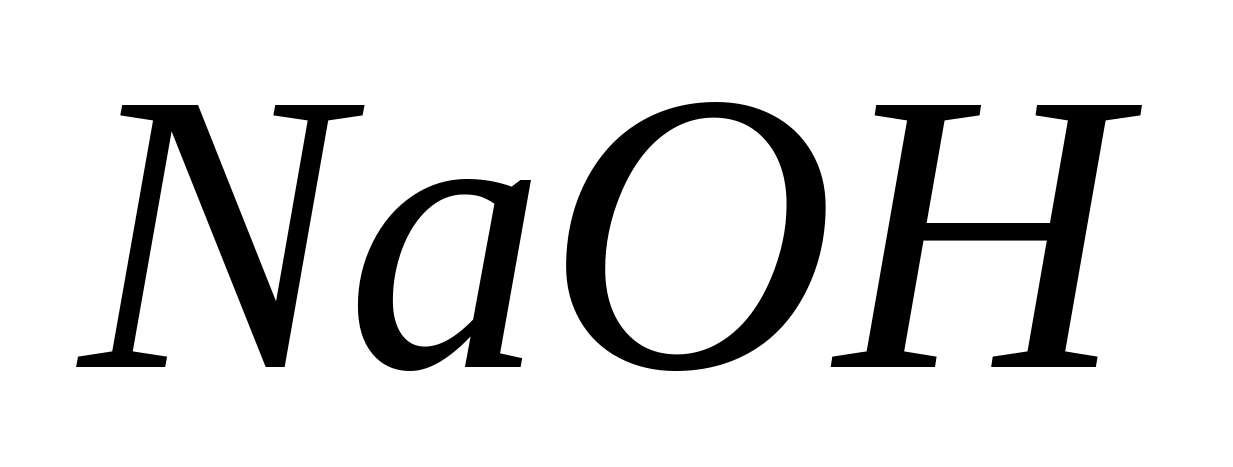 прилейте
раствор гидроксида аммония. Отметьте,
в какой из пробирок образуется больше
осадка.
прилейте
раствор гидроксида аммония. Отметьте,
в какой из пробирок образуется больше
осадка.
Реакция с моногидрофосфатом натрия

Микрокристаллоскопическая реакция.
Д![]() ля
микрокристаллоскопического обнаружения
ля
микрокристаллоскопического обнаружения
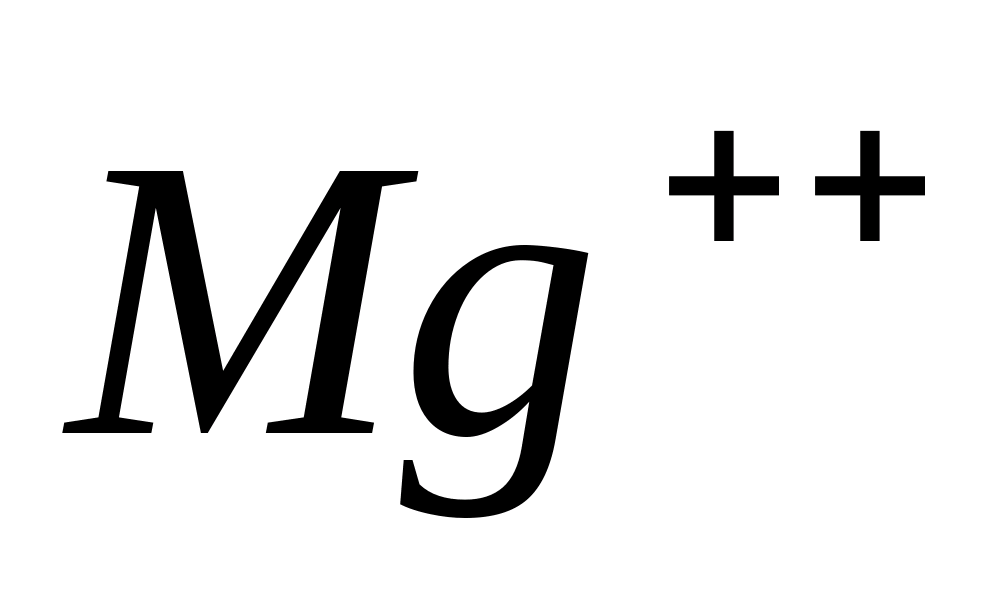 -
ионов в виде
-
ионов в виде
 поместите
каплю раствора
поместите
каплю раствора
 на
предметное стекло
. Затем к нему
прибавьте из капиллярной пипетки
сначала каплю раствора
на
предметное стекло
. Затем к нему
прибавьте из капиллярной пипетки
сначала каплю раствора
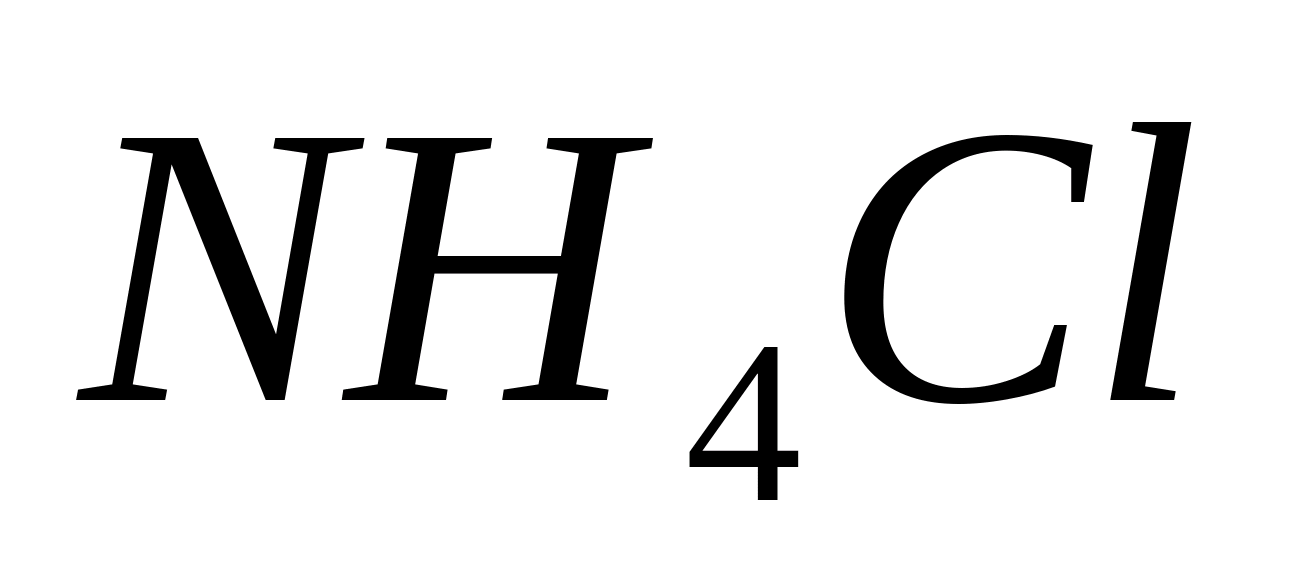 ,
затем каплю концентрированного водного
раствора аммиака. Наконец, внесите в
раствор кристаллик
,
затем каплю концентрированного водного
раствора аммиака. Наконец, внесите в
раствор кристаллик
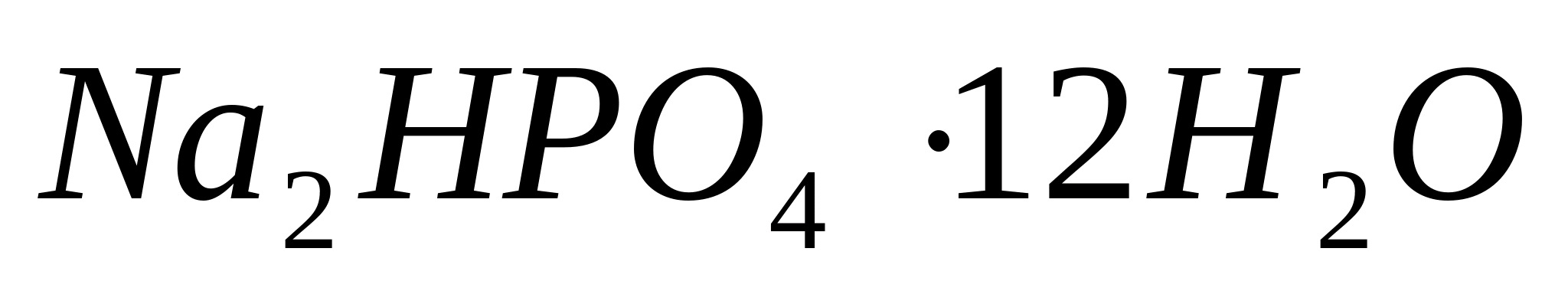 (гидрофосфат натрия). Предметное стекло
рекомендуется нагреть. В непосредственной
близости от кристалла фосфата натрия
появляются дендритные кристаллы, на
более дальнем расстоянии – правильно
образованные кристаллы в виде шестилучевых
звёзд. - фосфат магний-аммония
(гидрофосфат натрия). Предметное стекло
рекомендуется нагреть. В непосредственной
близости от кристалла фосфата натрия
появляются дендритные кристаллы, на
более дальнем расстоянии – правильно
образованные кристаллы в виде шестилучевых
звёзд. - фосфат магний-аммония

или в ионной форме
Рассмотрите кристаллы под микроскопом.
Ca ++
Реакция с оксалатом аммония.
Поместите в пробирку 1-2 капли раствора
какой-либо соли кальция, например
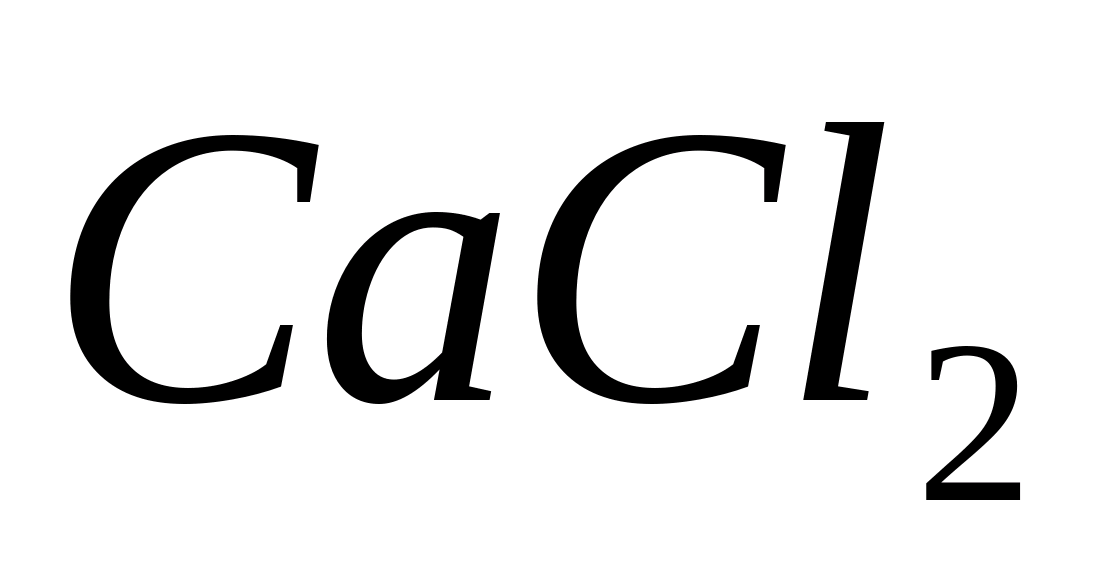 ,
и добавьте 1-2 капли уксусной кислоты,
чтобы реакция среды была кислой (в случае
индикатора метилового красного цвет
должен стать оранжевым). Прилейте
несколько капель раствора оксалата
аммония
,
и добавьте 1-2 капли уксусной кислоты,
чтобы реакция среды была кислой (в случае
индикатора метилового красного цвет
должен стать оранжевым). Прилейте
несколько капель раствора оксалата
аммония
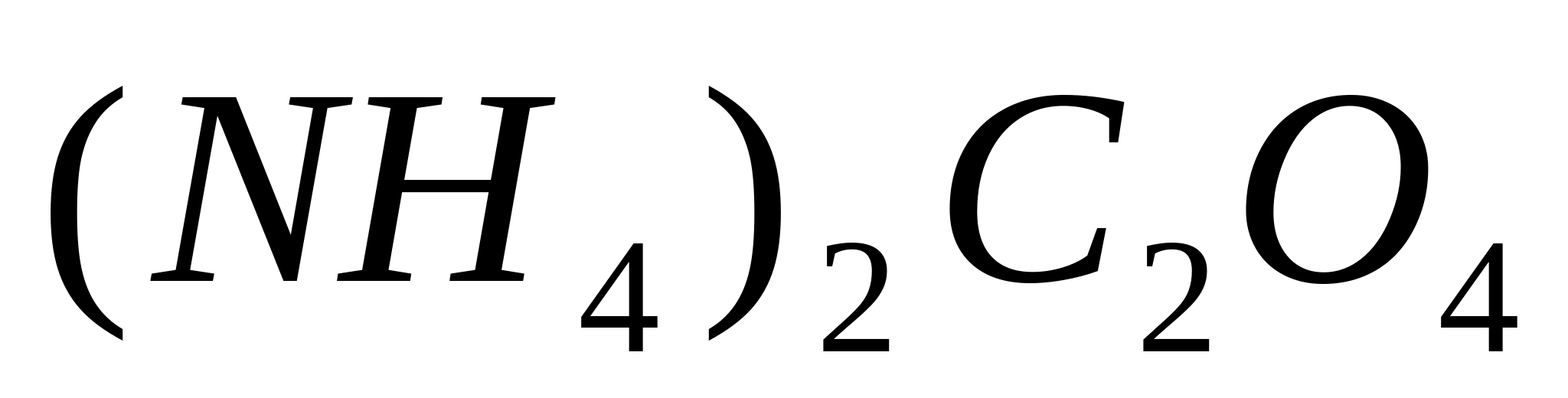 При этом из концентрированного раствора
сразу, а из разбавленного постепенно
выпадает белый мелкокристаллический
осадок
При этом из концентрированного раствора
сразу, а из разбавленного постепенно
выпадает белый мелкокристаллический
осадок
 .
В присутствии
.
В присутствии
 оксалат кальция осаждается количественно:
оксалат кальция осаждается количественно:
или в ионной форме:
Микрокристаллоскопическая реакция с серной кислотой .
П оместите
каплю раствора хлорида кальция на
предметное стекло, затем прибавьте
каплю разбавленной
оместите
каплю раствора хлорида кальция на
предметное стекло, затем прибавьте
каплю разбавленной
 и слегка упарьте смесь. При этом образуются
красивые характерные пучки игл
–
кристаллы гипса
и слегка упарьте смесь. При этом образуются
красивые характерные пучки игл
–
кристаллы гипса
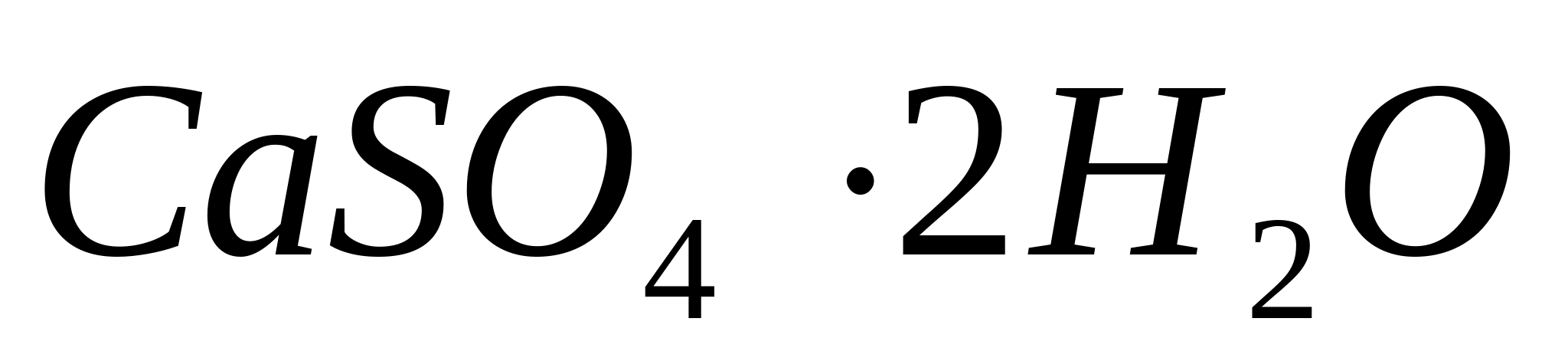 ,
легко различаемые под микроскопом.
,
легко различаемые под микроскопом.
Реакция окрашивания пламени
Ионы кальция окрашивают бесцветное пламя в кирпично-красный цвет.
Ba ++
Реакция с хроматом (или бихроматом) калия .
Поместите в пробирку 1-2 капли раствора
какой-либо соли бария, например
 ,
и прибавьте несколько капель раствора
,
и прибавьте несколько капель раствора
 или
или
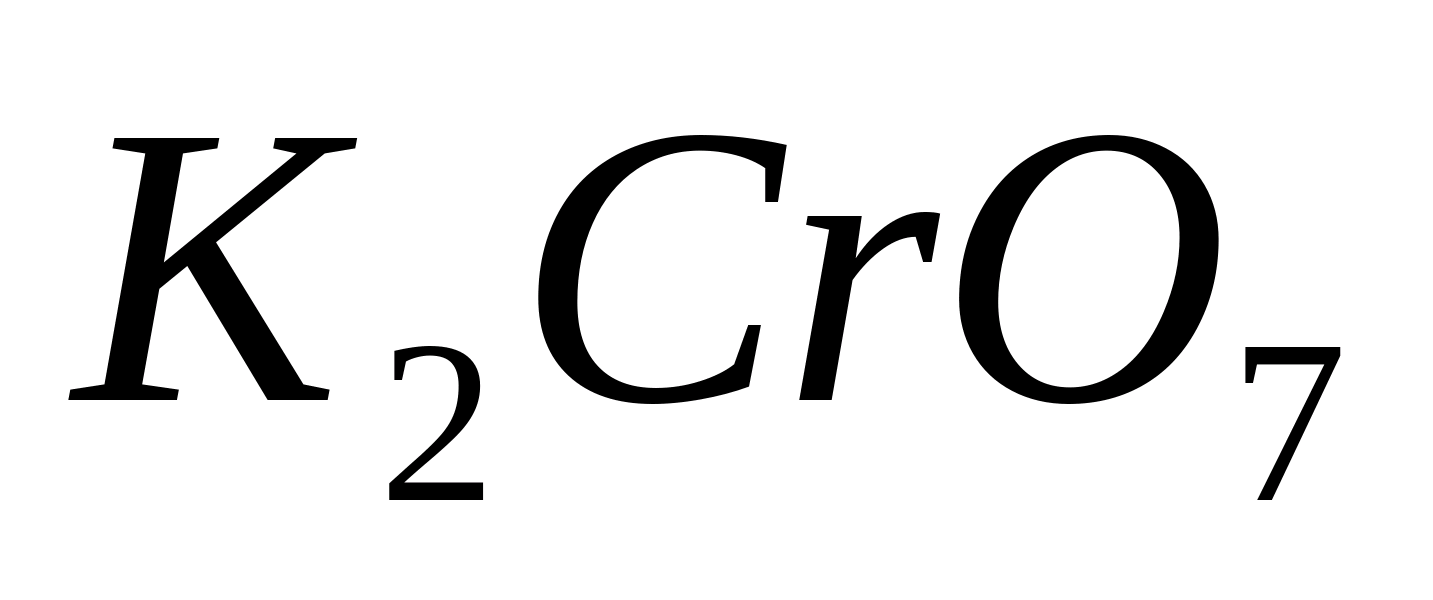 .
Нагрейте пробирку на пламени горелки.
При этом выпадает жёлтый кристаллический
осадок:
.
Нагрейте пробирку на пламени горелки.
При этом выпадает жёлтый кристаллический
осадок:
или в ионной форме:
или в ионной форме:
2![]()
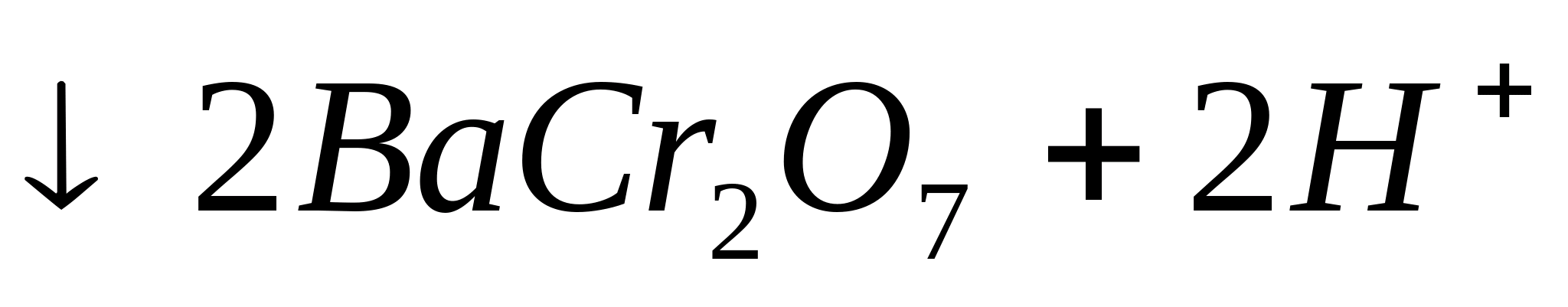
Капельная реакция с родизонатом натрия.
На фильтровальную бумагу поместите каплю нейтрального анализируемого раствора и затем каплю водного раствора родизоната натрия. Образуется красно-бурый осадок родизоната бария :
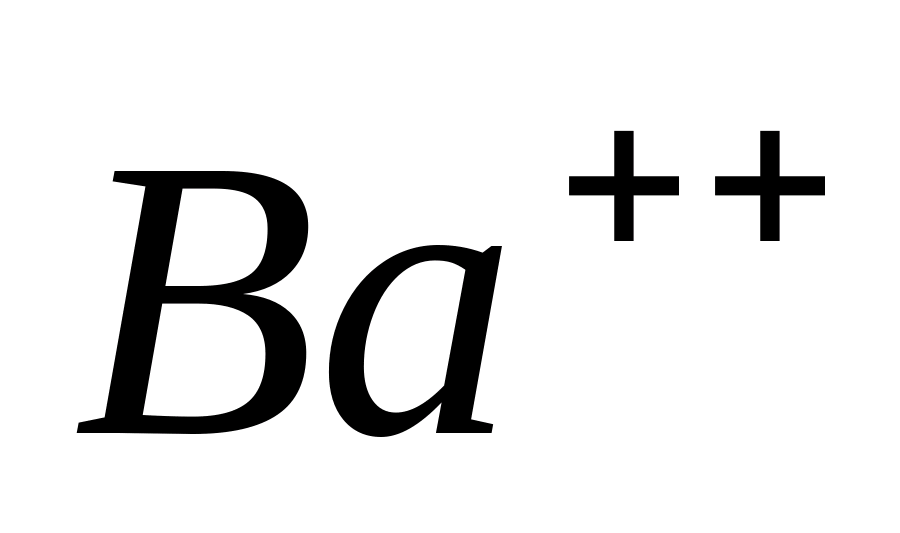 +
+

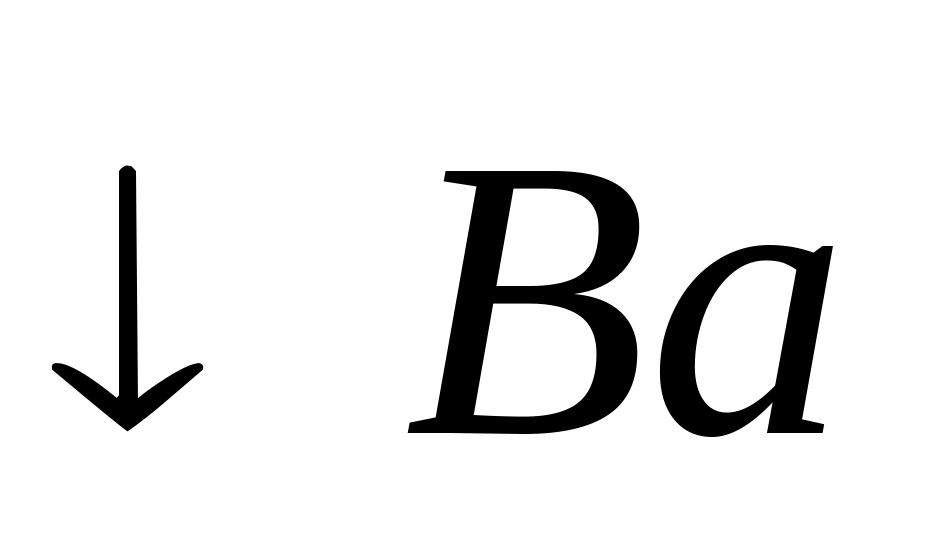 +
+
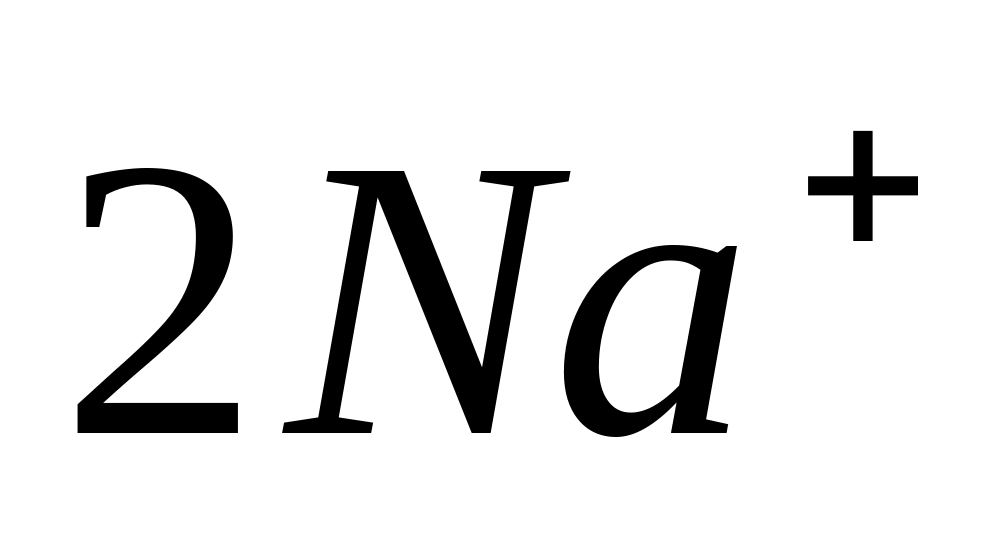

Родизонат бария на холоде в соляной кислоте превращается в ярко-красный гидрородизонат бария:
Реакция окрашивания пламени.
Бесцветное пламя окрашивается ионами бария в жёлто-зелёный цвет .
Реакция с серной кислотой или сульфатом аммония.
Поместите в пробирку несколько капель растворимой в воде соли бария, например,
хлорида
бария, прибавьте 1 мл разбавленной серной
кислоты или раствора сульфата аммония.
При этом выпадает белый кристаллический
осадок
сульфата бария
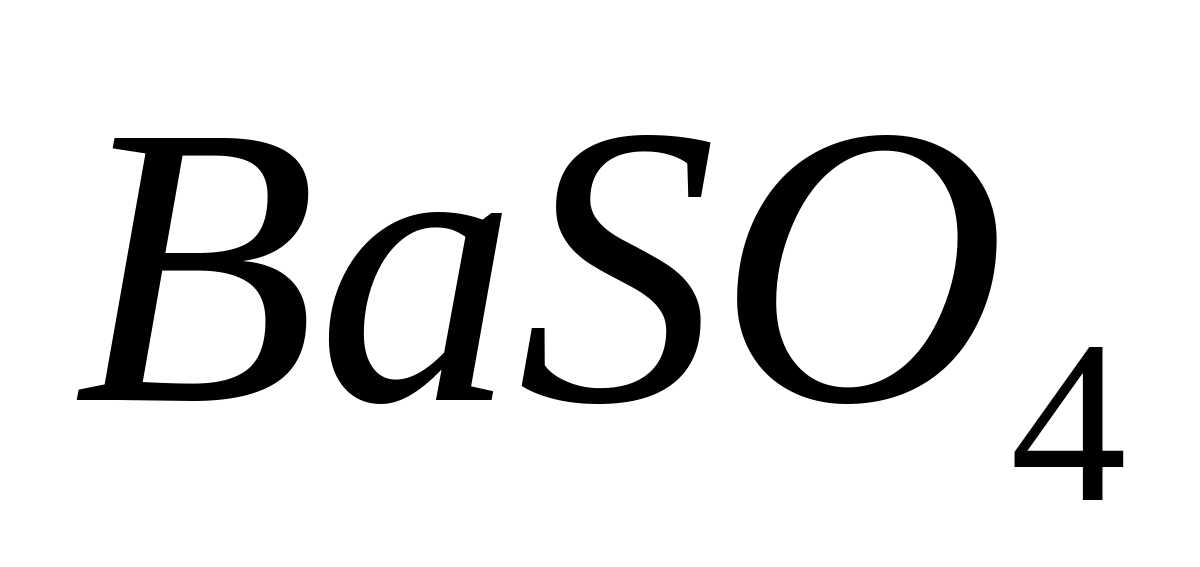 .
.
Al +++
Реакция с гидроксидом аммония.
Поместите в пробирку 1 мл раствора соли
алюминия, например,
 ,
прибавьте к нему несколько капель
раствора гидроксида аммония и нагрейте.
При этом выпадает белый
жел
е
образный
осадок
гидро
ксида
алюминия
:
,
прибавьте к нему несколько капель
раствора гидроксида аммония и нагрейте.
При этом выпадает белый
жел
е
образный
осадок
гидро
ксида
алюминия
:
или в ионной форме:
Осадок гидроксида алюминия вместе с раствором перенесите в центрифужную пробирку и отцентрифугируйте. Прозрачный раствор слейте, а осадок разделите на две части.
Проведите следующие проверочные реакции:

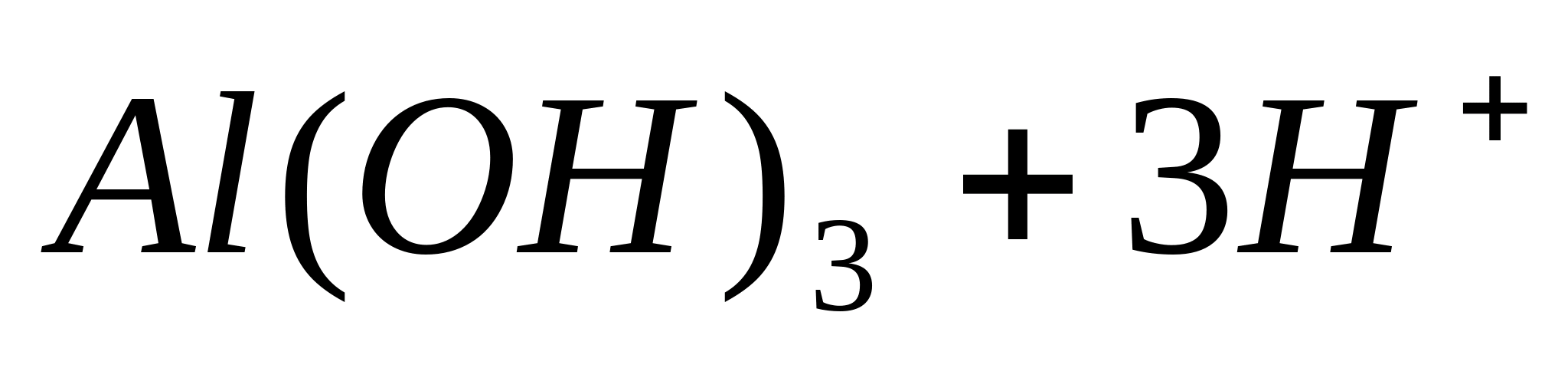

Следовательно, - типичное амфотерное соединение.
Реакция
с ализарином (1,2-диоксиантрахиноном)

Пробирочная
реакция. Поместите в пробирку 2 капли
раствора какой-либо соли алюминия и
прилейте 5 капель
 .
При этом образуется осадок
.
К полученному осадку прибавьте несколько
капель свежеприготовленного раствора
ализарина и прокипятите. Ализарин
образует с гидроокисью алюминия
соединение интенсивно красного цвета,
называемое алюминиевым лаком. Алюминиевый
лак не растворяется в разбавленной
уксусной кислоте. Поэтому после охлаждения
содержимого пробирки добавляют немного
уксусной кислоты до слабокислой реакции
(рН~4-5). В присутствии ионов алюминия
красный осадок не исчезает.
.
При этом образуется осадок
.
К полученному осадку прибавьте несколько
капель свежеприготовленного раствора
ализарина и прокипятите. Ализарин
образует с гидроокисью алюминия
соединение интенсивно красного цвета,
называемое алюминиевым лаком. Алюминиевый
лак не растворяется в разбавленной
уксусной кислоте. Поэтому после охлаждения
содержимого пробирки добавляют немного
уксусной кислоты до слабокислой реакции
(рН~4-5). В присутствии ионов алюминия
красный осадок не исчезает.
Условия проведения реакции .
При проведении пробирочной реакции значение pH в начале осаждения должно превышать 7, соответствуя слабоаммиачному раствору, а после осаждения pH может быть меньше 7, соответствуя разбавленному уксуснокислому раствору (pH = 4-5).
Реакцию ведут при кипячении.
Присутствие осадков других гидроокисей, хотя бы в небольших количествах, нежелательно, а в больших количествах недопустимо.
Cr +++
Окисление С r +3 хрома в Cr +6
Поместите в пробирку 2-3 капли раствора
сульфата или нитрата хрома (III), прибавьте
к нему 5 капель пероксида водорода
 ,
3-5 капель гидроксида калия КОН. Нагрейте
смесь до кипения.
,
3-5 капель гидроксида калия КОН. Нагрейте
смесь до кипения.
При этом происходит окисление
 -ионов
до
-ионов
до
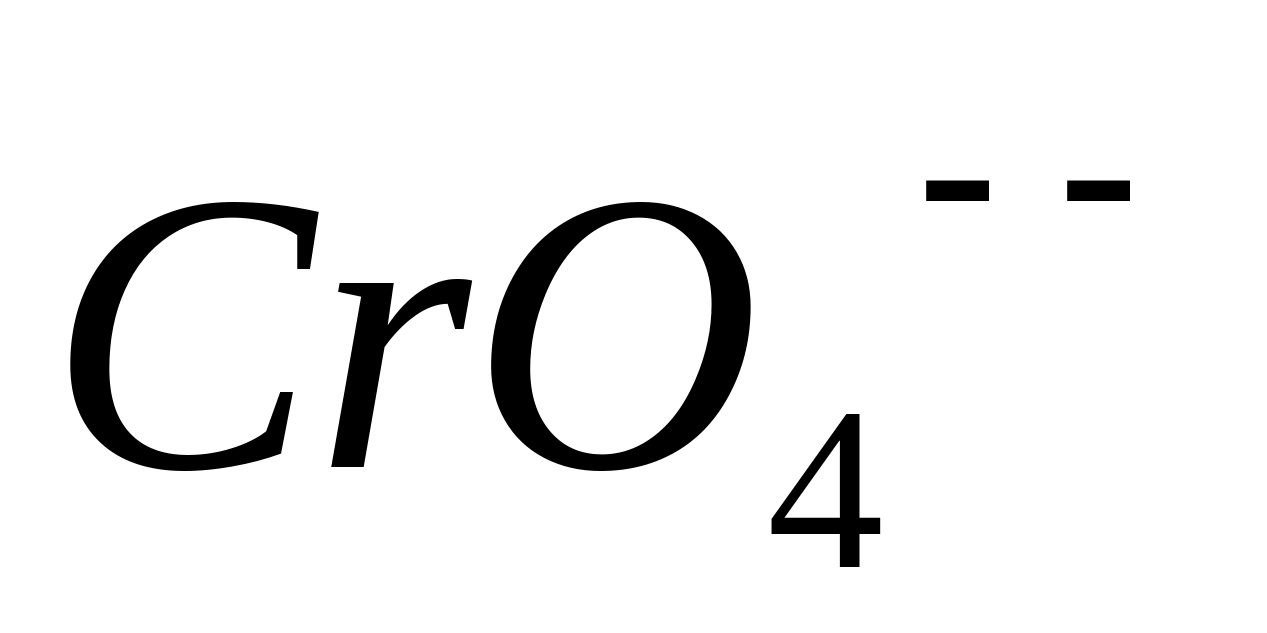 -ионов
и окраска из сине-зеленой
переходит
в желтую.
-ионов
и окраска из сине-зеленой
переходит
в желтую.
C полученным раствором проделайте следующие проверочные реакции, подтверждающие образование -ионов.
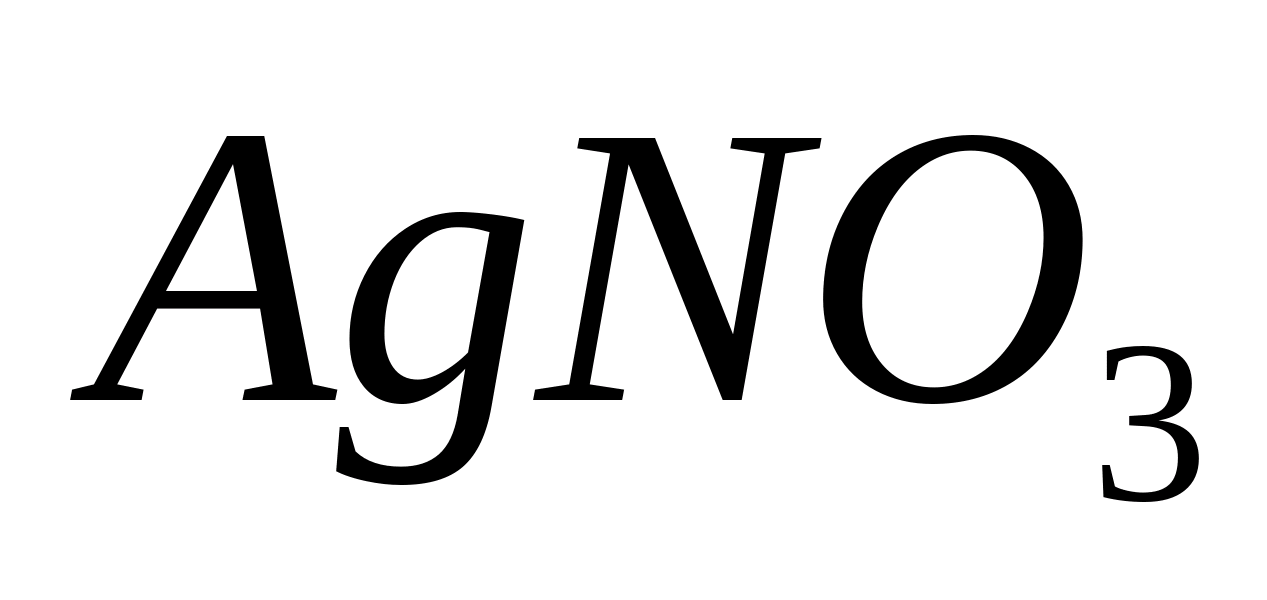
Fe +++
Реакция
с

Поместите в пробирку или на предметное
стекло 1-2 капли раствора
 , подкислите раствор 1-2 каплями
хлороводородной кислоты, прибавьте 2-3
капли желтой кровяной соли - раствора
гексацианоферрата (II)
калия
, подкислите раствор 1-2 каплями
хлороводородной кислоты, прибавьте 2-3
капли желтой кровяной соли - раствора
гексацианоферрата (II)
калия
 При этом выпадает темно-синий осадок
берлинской лазури:
При этом выпадает темно-синий осадок
берлинской лазури:
Реакция с роданидом аммония.
Поместите в пробирку 1 мл раствора
,
разбавьте его пятью каплями дистиллированной
воды и добавьте 3-5 капель раствора
роданида аммония
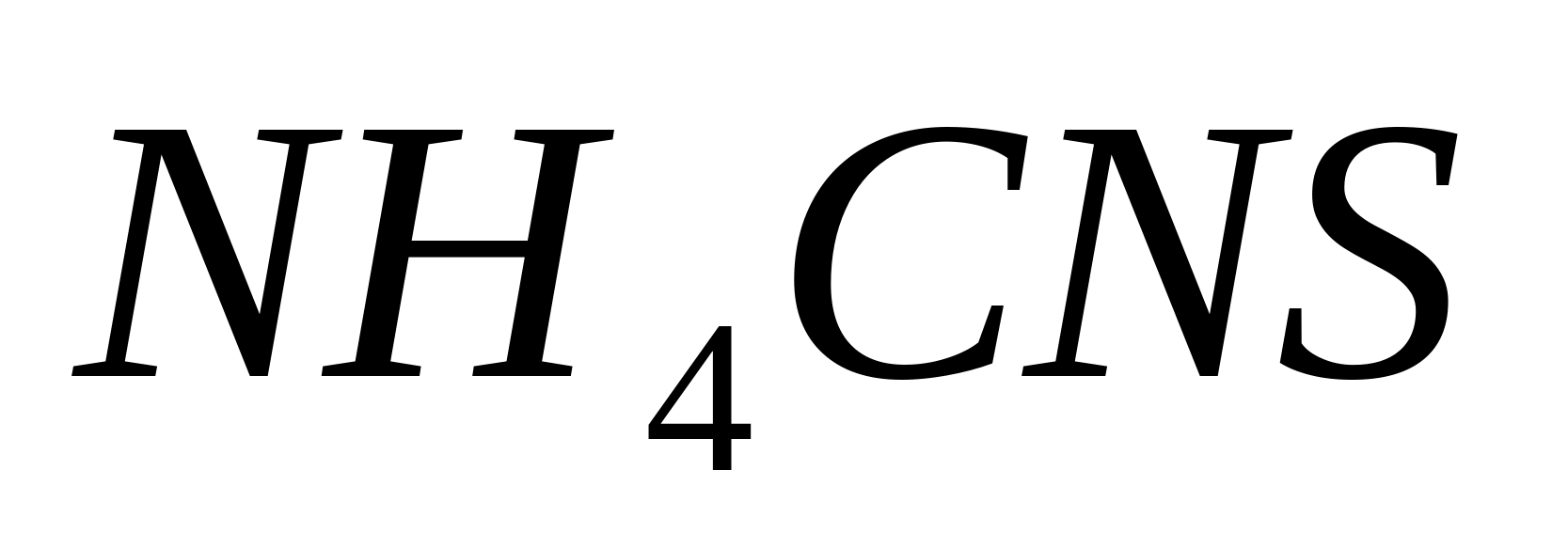 .
При этом появляется кроваво-красное
окрашивание
:
.
При этом появляется кроваво-красное
окрашивание
:
или в ионной форме:
Реакция с гидроксидом натрия, калия или аммония.
При действии растворов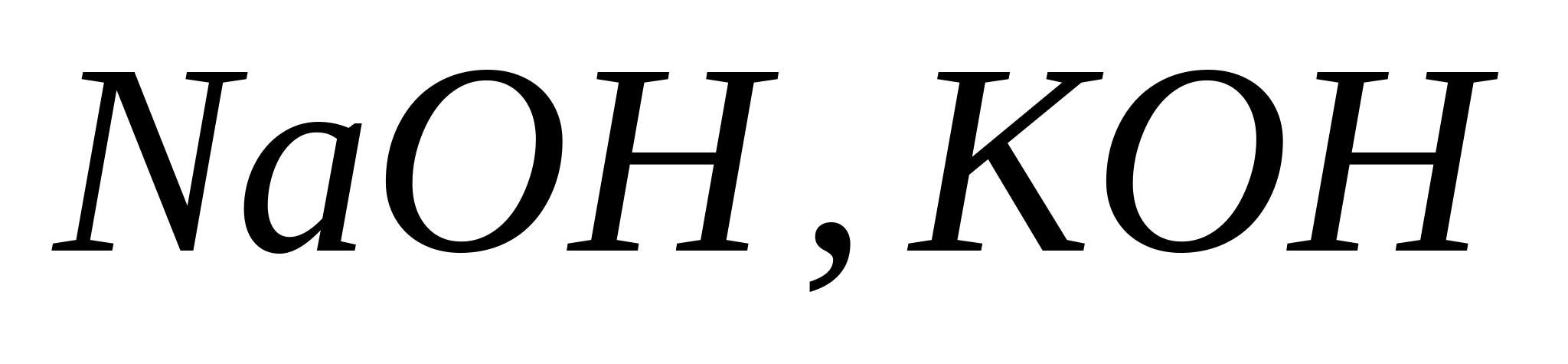 и
на ионы
и
на ионы
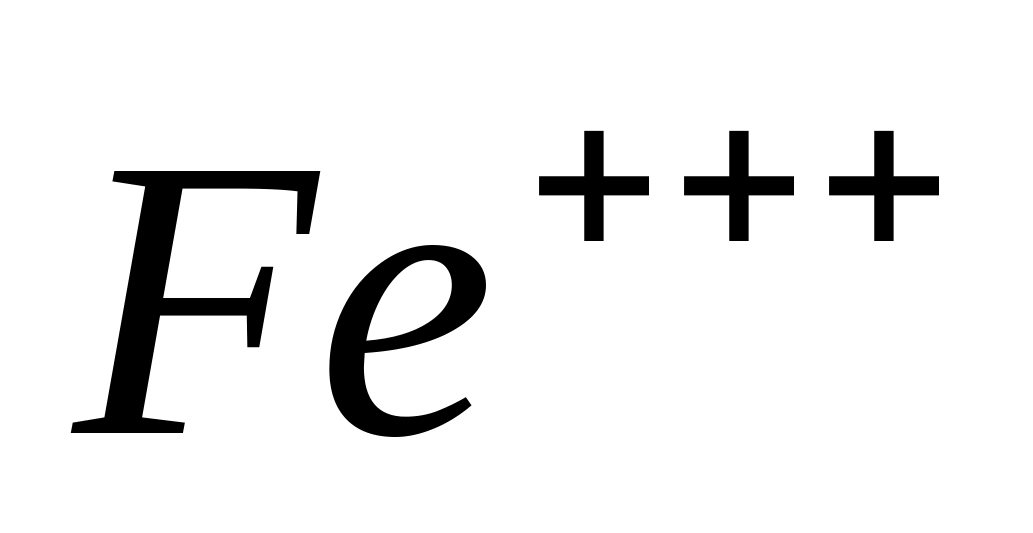 образуется
буро-красный осадок
Fe(ОН)з, растворимый
в кислотах:
образуется
буро-красный осадок
Fe(ОН)з, растворимый
в кислотах:
Fe ++
Реакция
с

Поместите в пробирку или на предметное стекло 1-2 капли раствора FeSO 4 , прибавьте 2-3 капли красной кровяной соли - раствора гексацианоферрата (III) калия При этом наблюдается образование турнбулевой сини:
Zn ++
Реакция с гидроксидом натрия, калия и аммония.
При действии гидроксида натрия или калия на хлорид цинка образуется белый осадок Zn (OH ) 2 , растворимый в избытке и .
Получите осадок гидроксида цинка в пробирке, отделите его от раствора с помощью центрифуги. Осадок разделите на две части. Растворите одну часть осадка в растворе кислоты, другую – в растворе основания. Напишите уравнения реакций, подтверждающих амфотерность гидроксида цинка.
Реакции Mn ++ -ионов
Реакция с гидроксидом натрия и перекисью водорода.
Для ионов марганца характерны реакции окисления - восстановления.
Одной из характерных реакций окисления
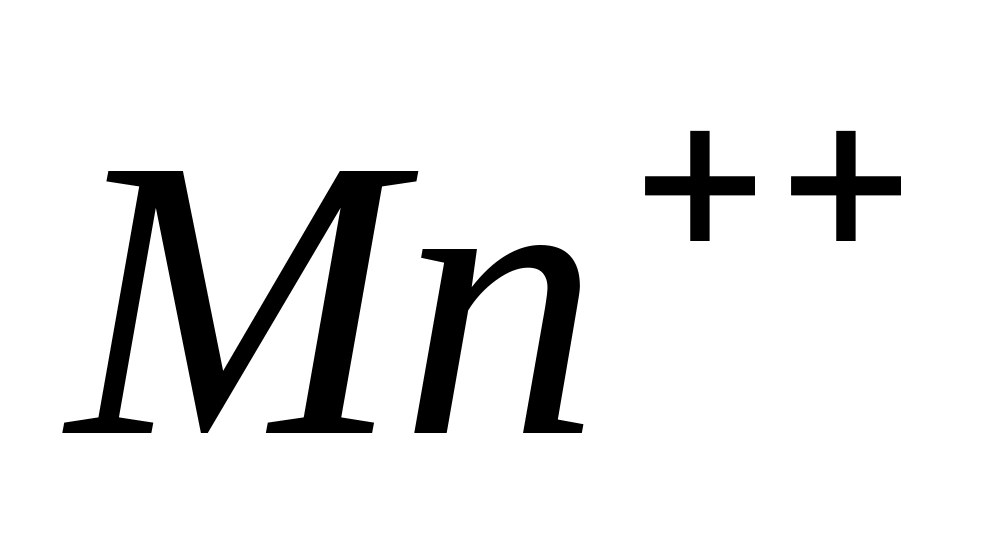 в щелочной среде является взаимодействие
его с.
При действии перекиси водорода в щелочной
среде бесцветные ионы марганца (II)
окисляются в нерастворимые соединения
марганца (IV)
в щелочной среде является взаимодействие
его с.
При действии перекиси водорода в щелочной
среде бесцветные ионы марганца (II)
окисляются в нерастворимые соединения
марганца (IV)
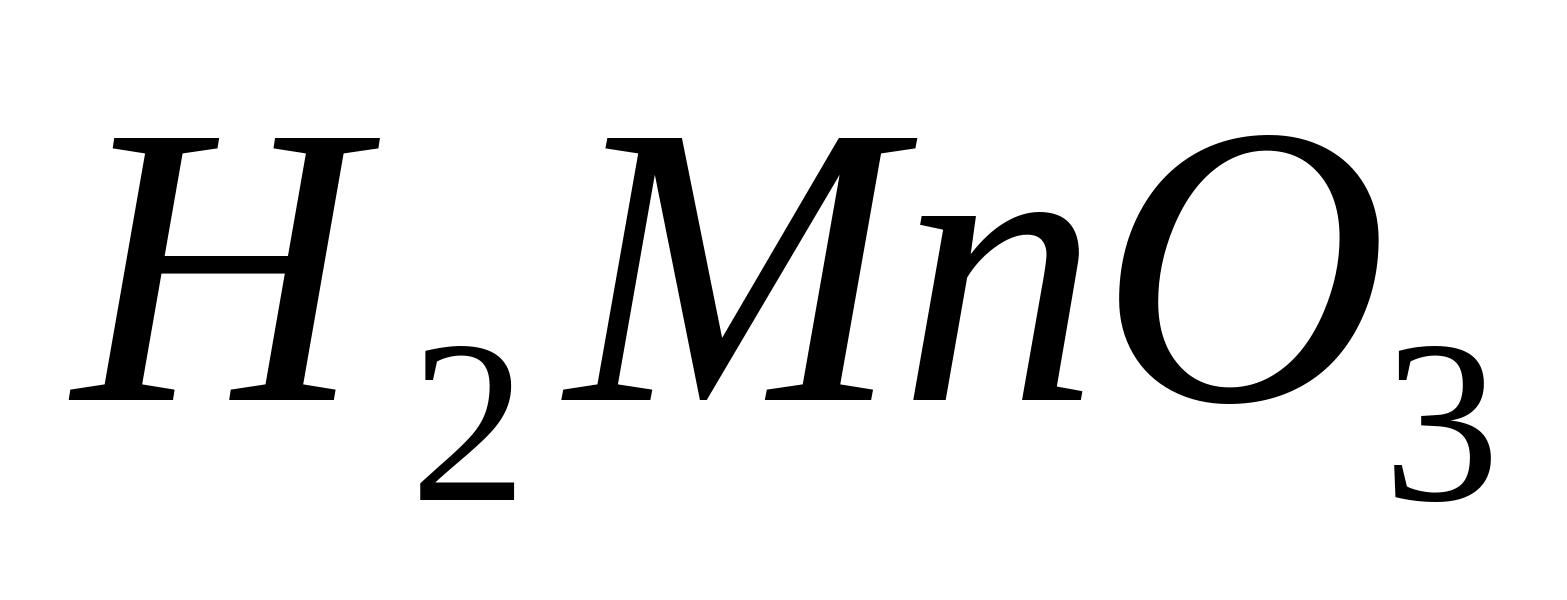 или
или
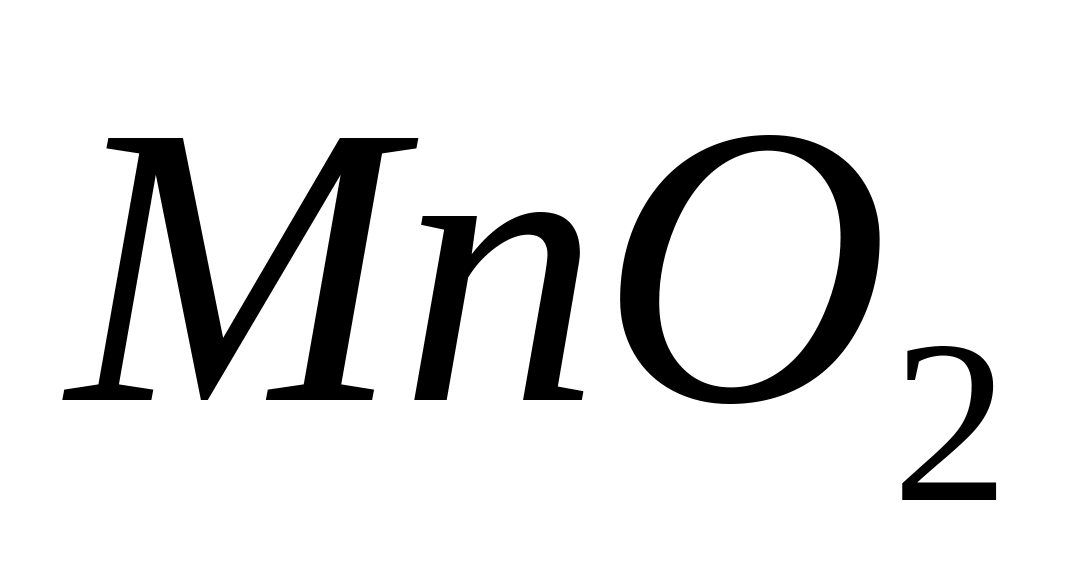 ,
окрашенные в бурый цвет:
,
окрашенные в бурый цвет:
или в ионной форме
Проведите окисление -ионов до. Для этого поместите в пробирку 1-3 капли раствора какой-либо соли марганца и прилейте несколько капель раствора NaOH. Образуется белый осадок гидроокиси марганца, медленно буреющий вследствие окисления на воздухе:
Прилейте к полученному осадку несколько капель . Осадок моментально становится буро-чёрным вследствие быстрого окисления ионов марганца (II) в .
Условия проведения реакции.
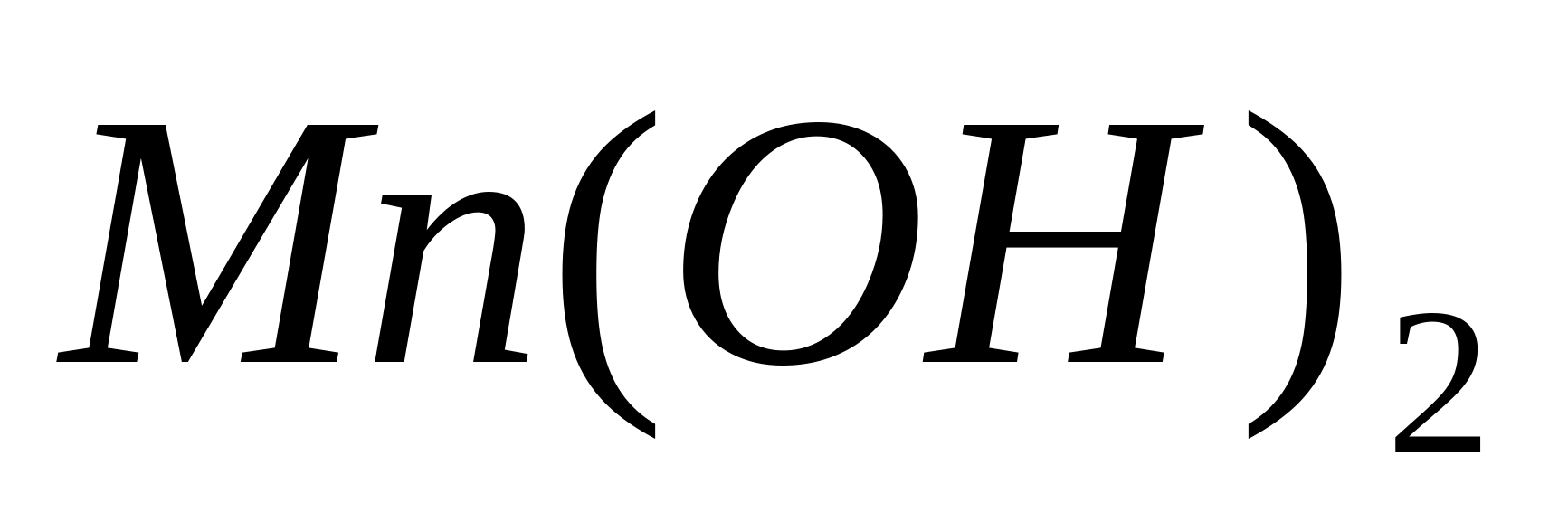
Окисление
-ионов
до
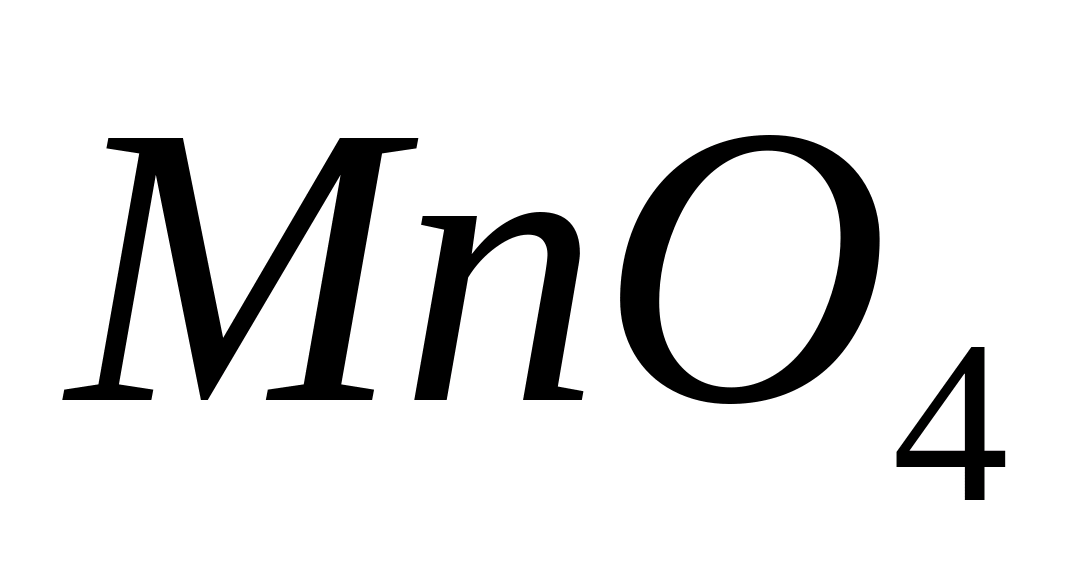 -
-ионов кислой среде.
-
-ионов кислой среде.
Соединения марганца (II) окисляются в
кислой среде сильными окислителями в
марганцовую кислоту. Одной из важнейших
реакций окисления в азотнокислой или
сернокислой среде является взаимодействие
-ионов
с
 или
или
 .
При этом бесцветные соединения
двухвалентного марганца ()
окисляются до соединений марганца со
степенью окисления +7 (
.
При этом бесцветные соединения
двухвалентного марганца ()
окисляются до соединений марганца со
степенью окисления +7 (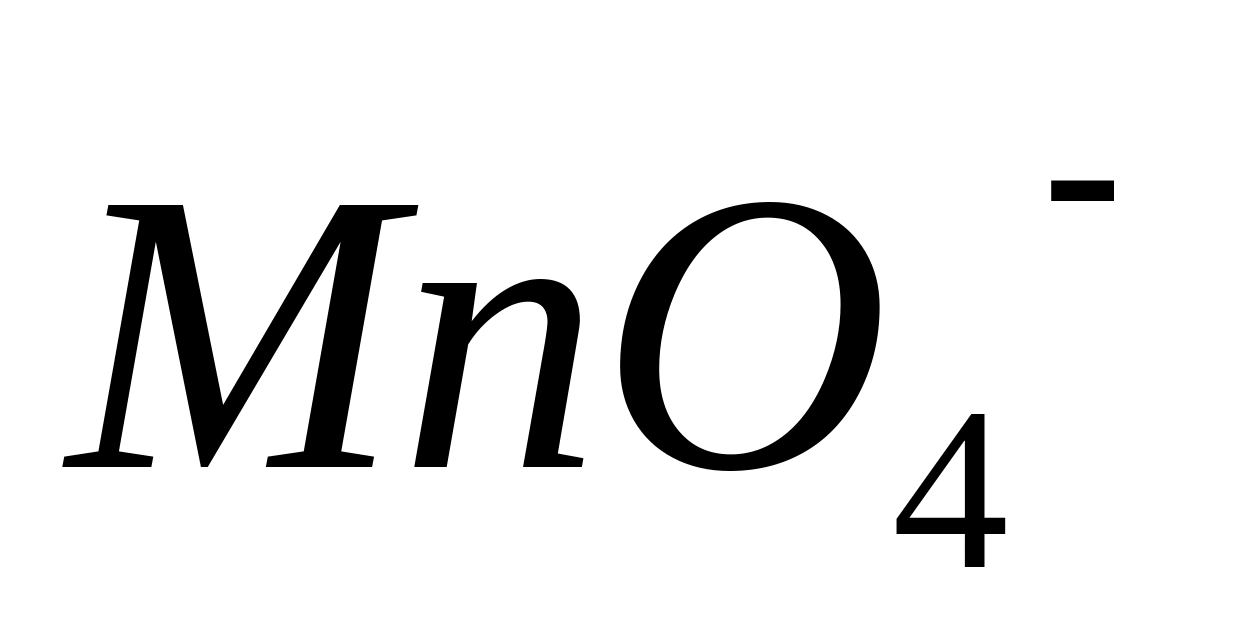 ),
окрашенных в фиолетово-красный цвет:
),
окрашенных в фиолетово-красный цвет:
или в ионной форме:
В присутствии восстановителей, в том
числе и
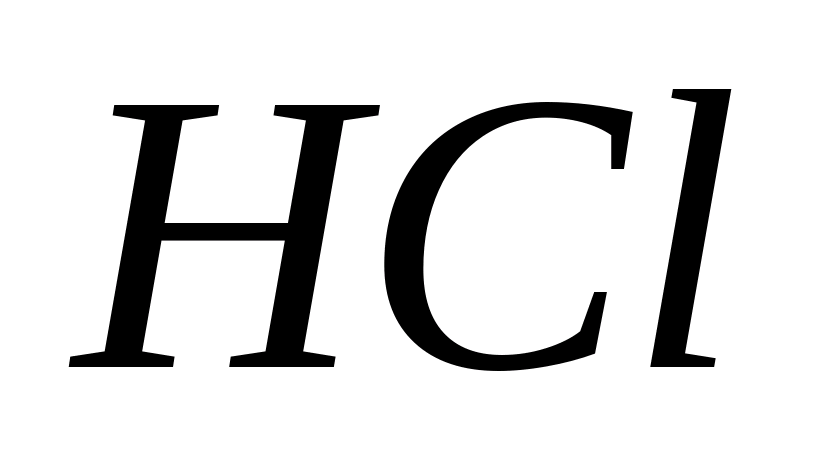 ,
происходит восстановление окислителей
и
.
Поэтому нельзя подкислять растворы
хлористоводородной кислотой.
,
происходит восстановление окислителей
и
.
Поэтому нельзя подкислять растворы
хлористоводородной кислотой.
Проведите окислениё -ионов до -ионов. Для этого поместите в пробирку 1-2 капли раствора какой-либо соли марганца (нитрата или сульфата, но не хлорида !), прилейте 5 капель разбавленной (1:1) азотной кислоты, добавьте небольшое количество окислителя (двуокиси свинца) и нагрейте смесь до кипения. Прилейте в пробирку 1-2 мл дистиллированной воды, не перемешивая, содержимого пробирки, и дайте смеси немного постоять. Появляется малиново-красная окраска, вызываемая образовавшейся марганцовой кислотой. Так как может содержать соединения марганца в виде примеси, рекомендуется ставить холостой опыт, соблюдая те же условия, но без добавления в пробирку испытуемого раствора. В отсутствие примесей окраска не появляется.
Описанная реакция окисления в марганцовую кислоту является весьма чувствительной реакцией.
Условия проведения реакции
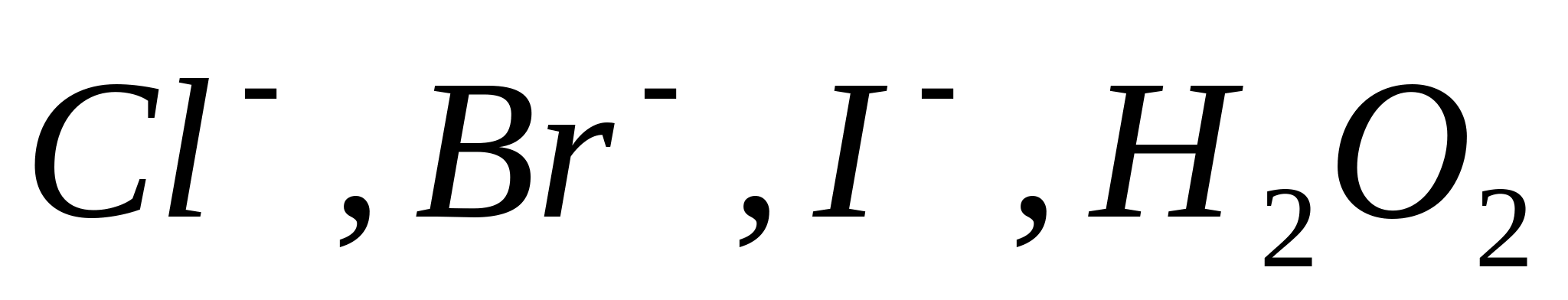
Качественный анализ анионов
Cl -
Реакция c нитратом серебра
K 1-2 мл раствора хлорида натрия или калия
добавьте несколько капель азотной
кислоты и раствора
 .
B присутствии Cl -
-ионов выпадает белый творожистый
осадок AgCl:
.
B присутствии Cl -
-ионов выпадает белый творожистый
осадок AgCl:
На свету осадок темнеет. Чтобы убедиться,
что полученный осадок действительно
содержит AgCl, так как
похожие осадки дают и другие ионы, осадок
промойте дистиллированной водой,
отцентрифугируйте. Воду слейте. К
полученному осадку прибавьте раствор
аммиака. При этом AgCl
растворяется, образуя комплексный
катион
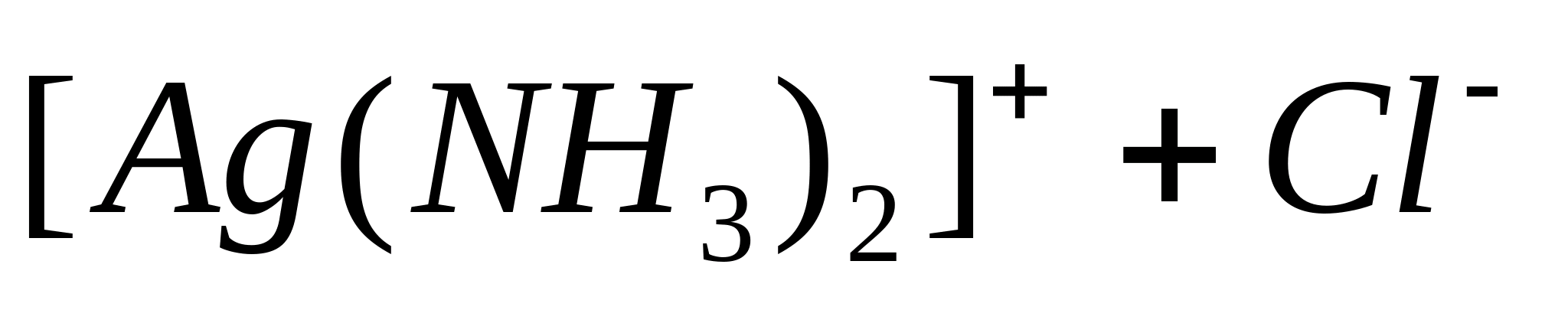 .
.
К раствору комплексного соединения
прилейте раствор разбавленной
 .
Комплексный ион разрушается и вновь
выпадает осадок AgCl.
Появление осадка служит доказательством
присутствия в анализируемом веществе
Cl - ионов. Описанные
реакции протекают согласно следующим
уравнениям:
.
Комплексный ион разрушается и вновь
выпадает осадок AgCl.
Появление осадка служит доказательством
присутствия в анализируемом веществе
Cl - ионов. Описанные
реакции протекают согласно следующим
уравнениям:

Реакция окисления
 -ионов
до свободного хлора
-ионов
до свободного хлора
Поместите в пробирку 5 капель раствора, содержащего -ионы, добавьте 0,5 мл
концентрированного раствора
 ,
5 капель концентрированной
и нагрейте (под тягой!). При этом наблюдается
частичное или полное обесцвечивание
раствора
и выделение газообразного
хлора, который открывают при помощи
иодкрахмальной бумаги (синее окрашивание).
,
5 капель концентрированной
и нагрейте (под тягой!). При этом наблюдается
частичное или полное обесцвечивание
раствора
и выделение газообразного
хлора, который открывают при помощи
иодкрахмальной бумаги (синее окрашивание).
Реакция протекает согласно уравнению:
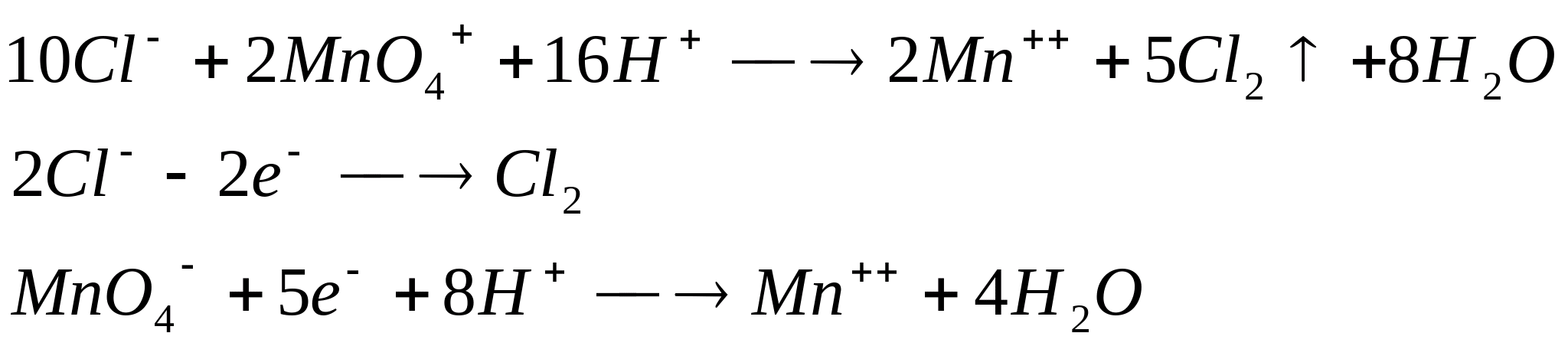
Для обнаружения выделяющегося С1 2 поднесите к отверстию пробирки влажную
иодкрахмальную бумагу. B присутствии хлора появляется синее окрашивание вследствие выделения элементарного иода:
Окисляющее действие на окaзывают манганиты, манганаты, перманганаты, двуокиси марганца и свинца, хромовый ангидрид, хлорноватистая, хлорноватая и aзотная кислоты и т. П
Условия проведения реакций.
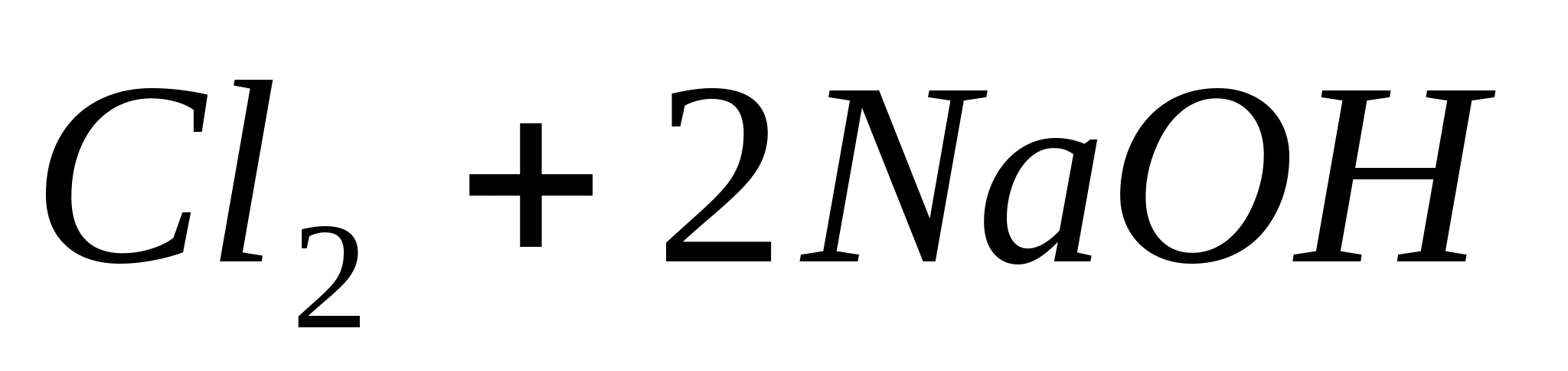
или в ионной форме:
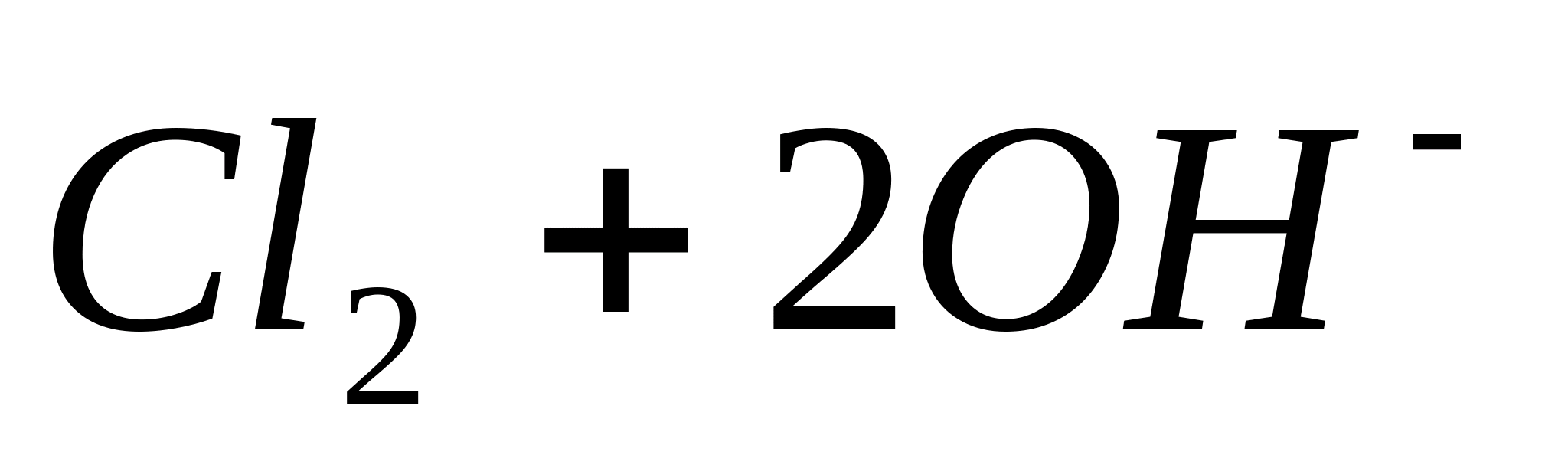
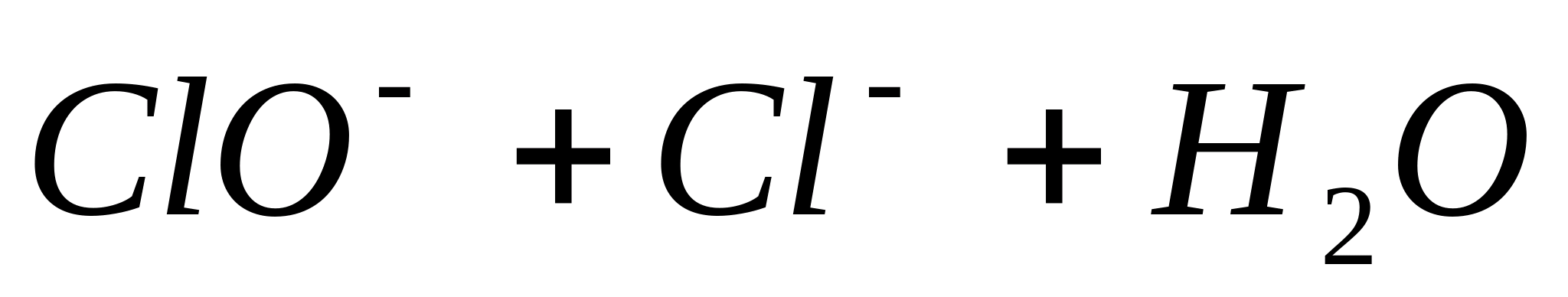
Br -
Реакция с нитратом серебра
K 1-2 мл раствора бромида натрия или калия
добавьте несколько капель азотной
кислоты и раствора
.
B присутствии
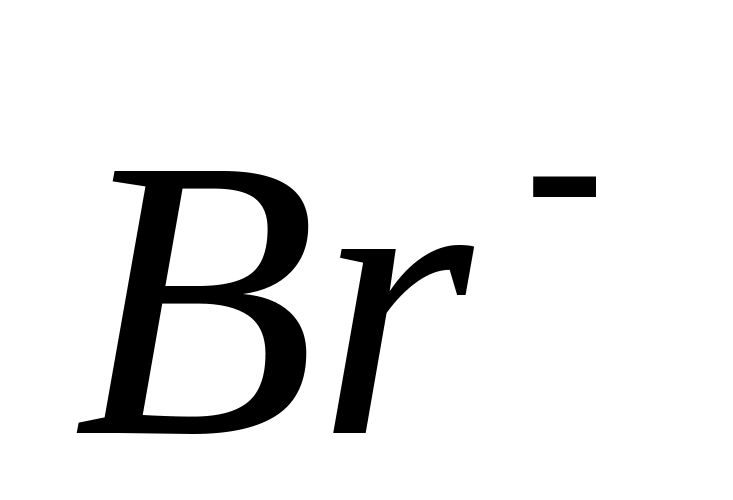 -ионов
выпадает желтоватый творожистый осадок
AgBr
. Проверьте его растворимость в
растворе тиосульфата натрия
-ионов
выпадает желтоватый творожистый осадок
AgBr
. Проверьте его растворимость в
растворе тиосульфата натрия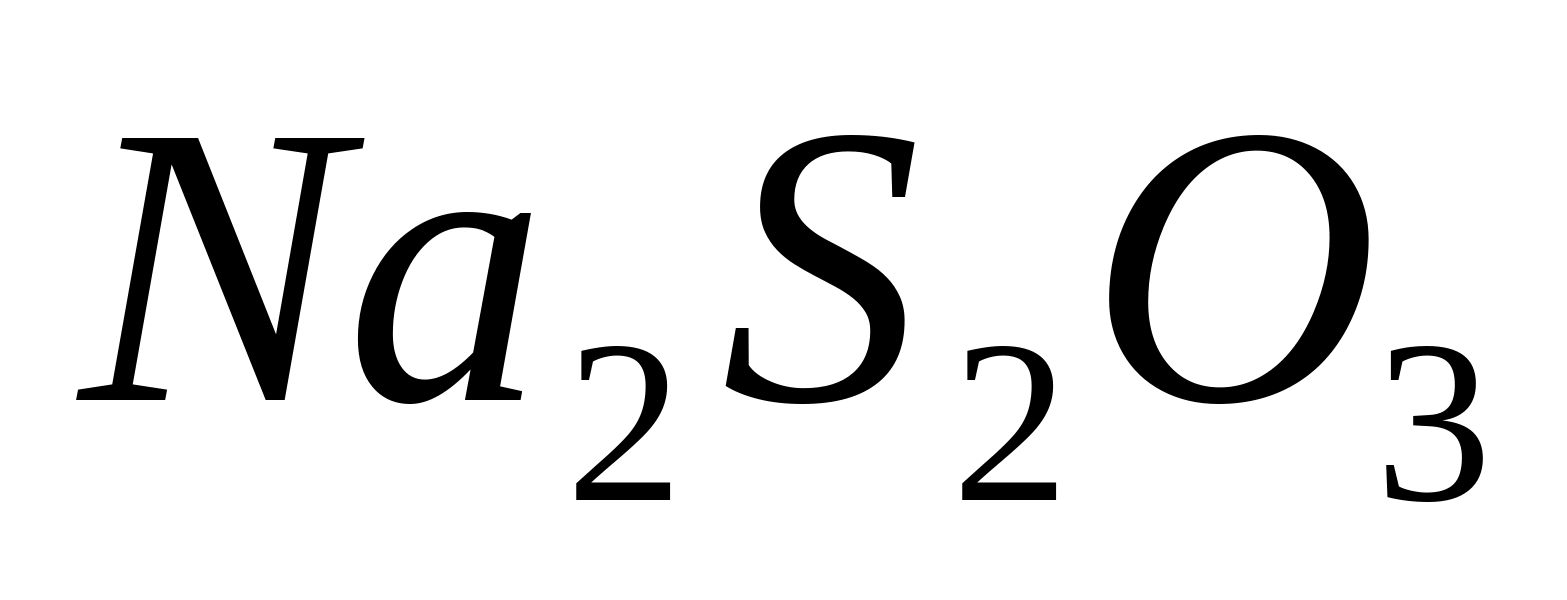 ,
в растворе аммиака и в растворе карбоната
аммония
,
в растворе аммиака и в растворе карбоната
аммония
 .
.
Реакция окисления -ионов хлорной водой до свободного брома
Поместите в пробирку 5 капель раствора KBr, 1-2 капли разбавленной ,
0,5 мл бензола и 2-3 капли хлорной воды. Встряхните пробирку. В присутствии -ионов бензол окрашивается в желто-бурый цвет.
Реакция
применима для обнаружения
-ионов в присутствии
- и
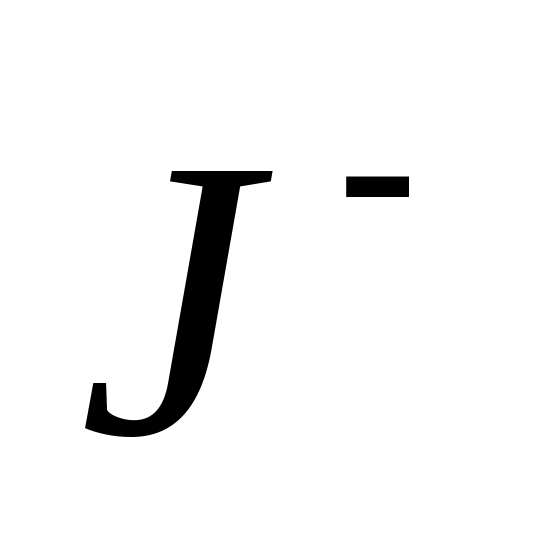 -ионов.
-ионов.
Условия проведения реакции.

J -
Реакция с нитратом серебра.
Ионы (в отличие от и -ионов) с ионами серебра образуют желтый творожистый осадок, растворимый только в растворах цианида калия и .
K 1-2 мл раствора иодида натрия или калия добавьте несколько капель азотной кислоты и раствора . Проверьте растворимость полученного осадка в растворе .
Реакция окисления - ионов хлорной водой до свободного иода
Реакцию проводят аналогично реакции окисления бромидов хлорной водой. Поместите в пробирку 5 капель раствора иодида калия KJ, 1-2 капли разбавленной серной кислоты, 0,5 мл
бензола и 1-2 капли хлорной воды. Встряхните содержимое пробирки. В присутствии -ионов слой бензола окрашивается в красно-фиолетовый цвет:
При избытке Cl 2 свободный иод не выделяется и слой бензола не окрашивается:
В качестве окислителей можно также пользоваться всеми окислителями, применяемыми для окисления HCl и HBr.
Условия проведения реакции .
Реакция окисления -ионов перманганатом калия
Поместите в пробирку 3-5 капель испытуемого раствора, содержащего -ионы, подкислите раствор несколькими каплями разбавленной и добавьте к нему 1-2 капли раствора .
В присутствии -ионов наблюдается обесцвечивание раствора на холоду и выделение иода. Умеренное нагревание способствует протеканию реакции:
Условия проведения реакции.
Как только появляется красное окрашивание, добавление раствора прекращают и его
избыток восстанавливают 1-2 каплями перекиси водорода. Избыток перекиси водорода разлагают кипячением раствора.
Иодат может быть легко обнаружен при добавлении к полученному раствору иодида калия. При этом происходит выделение иода в большем количестве, чем при окислении непосредственно перманганатом:
N0 3 -
Реакция восстановления нитратов до аммиака цинком или алюминием
Поместите в пробирку 5 капель раствора нитрата калия или натрия, прилейте к нему 0,5 мл раствора NaOH или КОН и затем добавьте 25-50 мг цинковой пыли или алюминиевого порошка. Для ускорения реакции смесь подогрейте на газовой горелке.
Цинковая пыль (или алюминиевый порошок) в щелочных растворах восстанавливает нитраты до аммиака:
Выделяющийся при этом аммиак обнаруживают, как описано ранее.
Взаимодействие с дифениламином
Поместите на предметное стекло 3 капли
раствора дифениламина
 в серной кислоте и 2 капли раствора
нитрата натрия. В присутствии
в серной кислоте и 2 капли раствора
нитрата натрия. В присутствии
 -ионов появляется темно-синее
окрашивание
, вызываемое продуктами
окисления дифениламина азотной кислотой.
-ионов появляется темно-синее
окрашивание
, вызываемое продуктами
окисления дифениламина азотной кислотой.
SO 3 --
Реакция восстановления сернистой кислоты
Поместите в пробирку 3-5 капель раствора
соли сернистой кислоты (например,
 ),
3-5 капель свежеприготовленного
хлористоводородного концентрированного
раствора
),
3-5 капель свежеприготовленного
хлористоводородного концентрированного
раствора
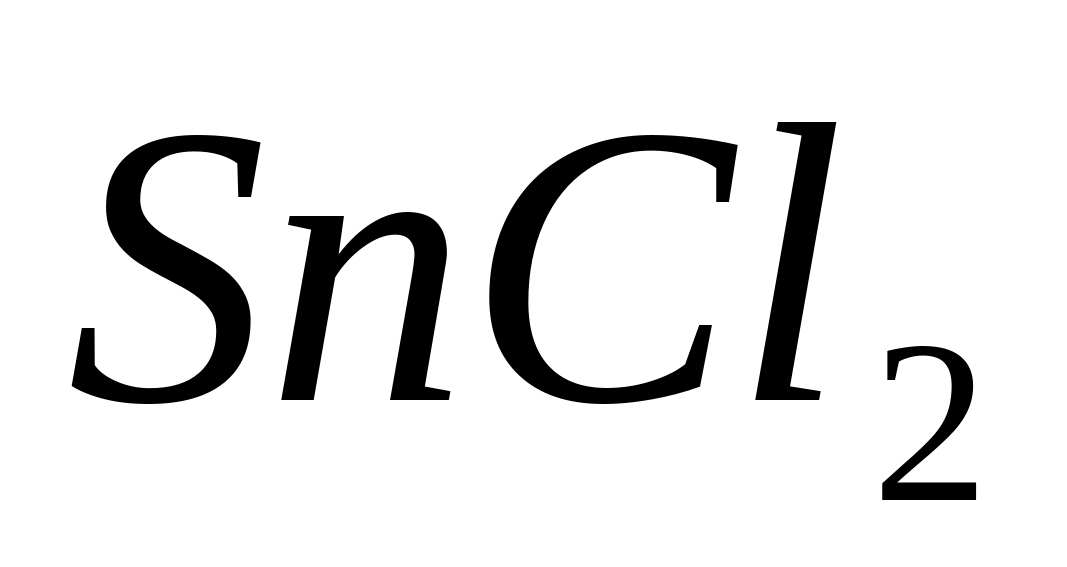 и содержимое пробирки нагрейте. При
этом
и содержимое пробирки нагрейте. При
этом
Поместите на листок фильтровальной
бумаги 1 каплю раствора
 и 1 каплю раствора родизоната натрия
или родизоновой кислоты. При этом
образуется красное пятно родизоната
бария. Красное пятно смочите 1-2 каплями
раствора сульфата натрия. В присутствии
сульфатов окраска родизоната бария
тотчас исчезает. Ионы бария с родизонатом
натрия или родизоновой кислотой дают
красно-бурый осадок, не разлагающийся
разбавленной НС1. Родизонат бария
моментально обесцвечивается сульфатами
и серной кислотой вследствие образования
нерастворимого сульфата бария.
Рассматриваемая реакция является
специфичной и применяется только для
обнаружения сульфатов.
и 1 каплю раствора родизоната натрия
или родизоновой кислоты. При этом
образуется красное пятно родизоната
бария. Красное пятно смочите 1-2 каплями
раствора сульфата натрия. В присутствии
сульфатов окраска родизоната бария
тотчас исчезает. Ионы бария с родизонатом
натрия или родизоновой кислотой дают
красно-бурый осадок, не разлагающийся
разбавленной НС1. Родизонат бария
моментально обесцвечивается сульфатами
и серной кислотой вследствие образования
нерастворимого сульфата бария.
Рассматриваемая реакция является
специфичной и применяется только для
обнаружения сульфатов.
СО 3 --
Р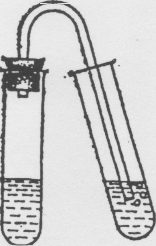 еакция
образования двуокиси углерода (углекислого
газа)
еакция
образования двуокиси углерода (углекислого
газа)
В пробирку поместите 1 мл раствора карбоната натрия Nа 2 СО 3 , прилейте к нему 2 М раствор НС1 и быстро закройте пробирку пробкой, в которую вставлена отводная трубка. Другой конец этой трубки опустите в пробирку с известковой водой (рис.).
Двуокись углерода, проходя через раствор Са(ОН) 2 , образует белый осадок или муть СаСО 3 .
Напишите уравнение реакции в молекулярной и ионной формах.
РО 4 ---
Реакция с молибдатом аммония
В пробирку налейте 1 мл раствора фосфата
натрия
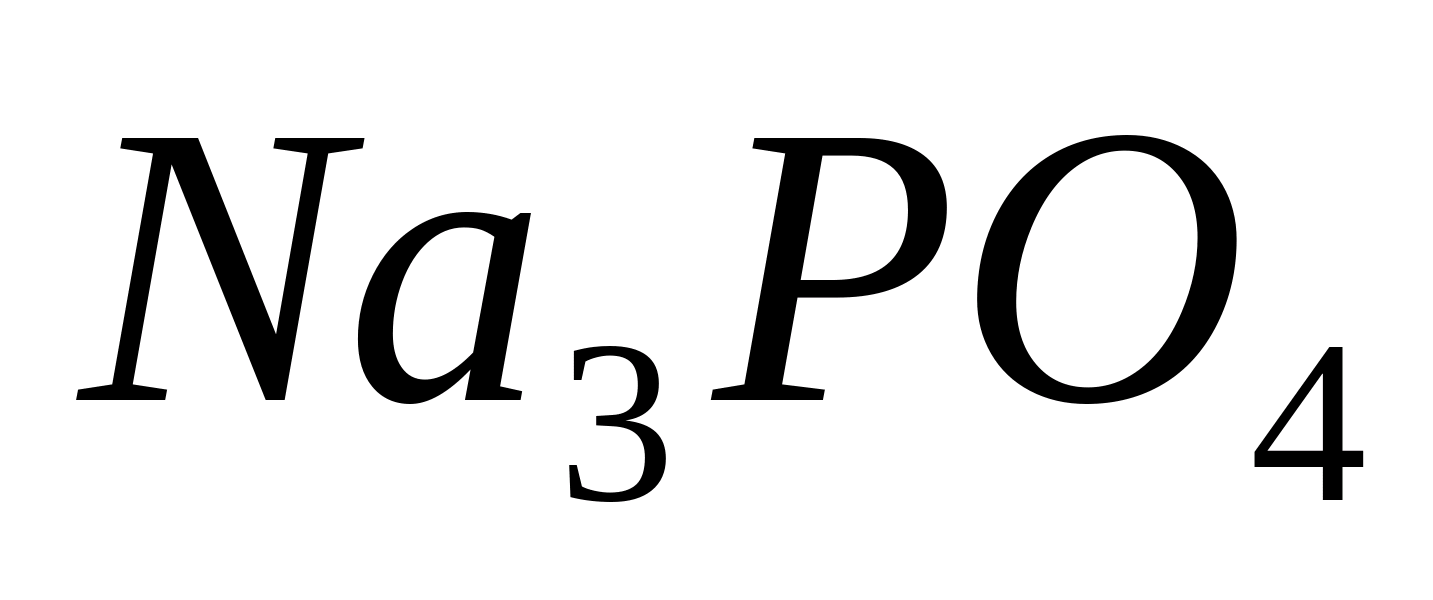 или
калия, добавьте несколько капель 6М HNO 3
и немного твердой соли – молибдата
аммония (NH 4) 2 MoO 4 .
Содержимое пробирки нагрейте.
Появляется желтый осадок фосфоромолибдата
аммония.
или
калия, добавьте несколько капель 6М HNO 3
и немного твердой соли – молибдата
аммония (NH 4) 2 MoO 4 .
Содержимое пробирки нагрейте.
Появляется желтый осадок фосфоромолибдата
аммония.
PO 4 3- + 3NH 4 + + 12 MoO 4 2- + 24 H + = (NH 4 ) 3 PO 4 ∙12 MoO 3 ∙2H 2 O↓ + 10 H 2 O
Осадок легко растворяется в водном растворе аммиака.
Контрольная задача.
Дана соль. Определить, какой катион и анион входят в её состав.
Анализ соли
1. Предварительные испытания
а) Окрашивание пламени.
Na + - желтый
Ca 2+ - кирпично-красный
K + - фиолетовый
Ba 2+ - желто-зеленый
Cu 2+ - зеленый.
в) Проверка рН водных растворов.
Если рН > 7, то в состав соли входит катион сильного основания (щелочного или щелочноземельного металла)
Если рН = 7, следовательно, это соль, образованная сильным основанием и сильной кислотой.
г) Действие разбавленной серной кислоты – только карбонат-ионы СО 3 2 – разлагаются разбавленными кислотами с выделением CO 2 .
д) Действие концентрированной серной кислоты – разлагает Cl - , Br – , J - , NO 3 - , MnO 4 - с выделением Cl 2, HCl, HBr, Br 2 , J 2 , NO 2 , O 2 и т.д.
е) Обнаружение некоторых катионов.
NH 4 +
К капле пробы прилить раствор реактива Несслера. Появление красно-коричневого осадка доказывает наличие иона аммония в соли.
К пробе прилить раствор гидроксида натрия, нагреть. При наличии в соли иона аммония появляется запах аммиака, а на палочке, смоченной раствором концентрированной соляной кислоты – белый налет хлорида аммония.
Fe 3+
К пробе прилить раствор K 4 . Образуется осадок берлинской лазури.
К пробе прилить несколько капельКСNS. Появляется красное окрашивание.
Fe 2+ К пробе прилить раствор K 3 . Отмечается появление турнбулевой сини.
2. Ход анализа .
1. Cначала в пробе определяют катионы.
2. На втором этапе анализа в пробе определяют анионы. Перед этим проводят предварительные испытания на содержание ионов Cl - , SO 4 -2 . Для этого к отдельным порциям пробы приливают растворы AgNO 3 и Ba(NO 3) 2 . Выпадение творожистого осадка Ag Cl и кристаллического Ba SO 4 свидетельствуют о наличии указанных ионов в пробе.
ДокументКонтрольная работа № 1 Качественный анализ . Гетерогенные равновесия ОБРАЗЕЦ РЕШЕНИЯ Качественный анализ Групповые и качественные реакции на катионы и анионы, необходимые...
Анализ гормонов, антигенов,антител и витаминов (2)
АнализТенге 590 тенге 179. Эозинофильный катионный белок (ECP) 5 р.д. - ... р.д.-1500 тенге 52.Вирус гепатита В (качественный анализ ) /Real-time/ (чувствительность 5 МЕ... 3-5 р.д.-5000 тенге 54.Вирус гепатита D (качественный анализ ) /Real-time/ кровь с ЭДТА 1-2 ...
Рабочая программа дисциплины «аналитическая химия» Профессия: «Лаборант- эколог»
Рабочая программаНа окраску комплексов. 1ч ТЕМА: Качественный анализ катионов и анионов 1.Взаимодействие ионов бария... (1). Тема 6 Качественный анализ катионов и анионов. Сероводородная классификация катионов . Первая аналитическая группа катионов (катионов группы натрия...
Дылдина Юлия
Пламя может иметь разный цвет, все зависит лишь от соли металла, которую в нее добаляют.
Скачать:
Предварительный просмотр:
МАОУ СОШ № 40
Тема
Окрашивание пламени как один из методов аналитической химии.
Дылдина Юдия,
9г кл., МАОУ СОШ № 40
Руководитель:
Гуркина Светлана Михайловна,
Учитель биологии и химии.
Пермь, 2015
- Введение.
- Глава 1 Аналитическая химия.
- Глава 2 Методы аналитической химии.
- Глава 3 Реакции окрашивания пламени.
- Заключение.
Введение.
С самого раннего детства меня завораживала работа ученых-химиков. Они казались волшебниками, которые познав какие-то скрытые законы природы, творили неведомое. В руках этих волшебников вещества меняли цвет, загорались, нагревали или охлаждались, взрывались. Когда я пришла на уроки химии, то занавеса начала приподниматься, и я начала понимать, как происходят химические процессы. Пройденного курса химии мне оказалось мало, поэтому я решила поработать над проектом. Хотелось, чтобы тема, над которой я работаю, была содержательной, помогла лучше подготовиться к экзамену по химии и удовлетворила мою тягу к красивым и ярким реакциям.
Окрашивание пламени ионами металлов в разные цвета мы изучаем еще на уроках химии, когда проходим щелочные металлы. Когда я заинтересовалась этой темой, оказалось, что в данном случае, она не раскрыта до конца. Я решила изучить ее более подробно.
Цель: с помощью данной работы я хочу научиться определять качественный состав некоторых солей.
Задачи:
- Познакомиться с аналитической химией.
- Изучить методы аналитической химии и выбрать наиболее приемлемый для моей работы.
- С помощью эксперимента определить какой металл входит в состав соли.
Глава 1.
Аналитическая химия.
Аналитическая химия - раздел химии, изучающий химический состав и отчасти структуру веществ.
Цель данной науки заключается в определении химических элементов или групп элементов, входящих в состав веществ.
Предмет её изучения является совершенствование существующих и разработка новых методов анализа, поиск возможностей их практического применения, исследование теоретических основ аналитических методов.
В зависимости от задачи методов различают качественный и количественный анализ.
- Качественный анализ - совокупность химических, физико-химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений, входящих в состав анализируемого вещества или смеси веществ. В качественном анализе можно использовать легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Такие реакции называют качественными и с помощью них можно с легкостью проверить состав вещества.
Качественный анализ чаще всего проводят в водных растворах. Он основан на ионных реакциях и позволяет обнаружить катионы или анионы веществ, которые там содержатся. Основоположником такого анализа считается Роберт Бойль. Он ввёл это представление о химических элементах как о не разлагаемых основных частях сложных веществ, после чего он систематизировал все известные в его время качественные реакции.
- Количественный анализ - совокупность химических, физико-химических и физических методов определения соотношения компонентов, входящих в состав
анализируемого вещества. По результатам этого можно определить константы равновесия, произведения растворимости, молекулярные и атомные массы. Такой анализ выполнять сложнее, так как он требует аккуратного и более кропотливого подхода, в ином случае результаты могут давать высокие погрешности и работа будет сведена к нулю.
Количественному анализу обычно предшествует качественный анализ.
Глава 2.
Методы химического анализа.
Методы химического анализа делят на 3 группы.
- Химические методы основаны на химических реакциях.
В данном случае для анализа можно использовать только такие реакции, которые сопровождаются наглядным внешним эффектом, например изменением окраски раствора, выделением газов, выпадением или растворением осадков и т. п. Эти внешние эффекты и послужат в данном случае аналитическими сигналами. Происходящие химические изменения называют аналитическими реакциями, а вещества, вызывающие эти реакции - химическими реагентами.
Все химические методы делят на две группы:
- Реакцию проводят в растворе, так называемым «мокрым путем».
- Способ выполнения анализа с твердыми веществами без использования растворителей, такой способ называют «сухим путем». Он делится на пирохимический анализ и анализ методом растирания. При пирохимическом анализе и сследуемое вещество нагревают в пламени газовой горелки. При этом летучие соли (хлориды, нитраты, карбонаты) ряда металлов придают пламени определенную окраску. Другой прием пиротехнического анализа-получение окрашенных перлов (стекол). Для получения перлов соли и оксиды металлов сплавляют с тетраборатом натрия (Na2 В4О7" 10Н2О) или гидрофосфатом натрия-аммония (NaNH4HP04 4Н20) и наблюдают окраску образующихся стекол (перлов).
- Метод растирания был предложен в 1898 г. Ф. М. Флавицким. Твердое исследуемое вещество растирают с твердым реагентом, при этом наблюдают внешний эффект. Например, соли кобальта с тиоцианатом аммония могут дать синее окрашивание.
- При анализе физическими методами изучают физические свойства вещества с помощью приборов, не прибегая к химическим реакциям. К физическим методам можно отнести спектральный анализ, люминесцентный, рентгеноструктурный и другие способы анализов.
- С помощью физико-химических методов изучают физические явления, которые происходят в химических реакциях. Например, при колориметрическом методе измеряют интенсивность окраски в зависимости от концентрации вещества, в кондуктометрическом анализе измеряют изменение электрической проводимости растворов.
Глава 3.
Лабораторная работа.
Реакции окрашивания пламени.
Цель: Изучить окрашивания пламени спиртовки ионами металлов.
В своей работе я решила воспользоваться методом пиротехнического анализа окрашивания пламени ионами металлов.
Исследуемые вещества: соли металлов (фторид натрия, хлорид лития, сульфат меди, хлорид бария, хлорид кальция, сульфат стронция, хлорид магния, сульфат свинца).
Оборудование: фарфоровые чашки, этиловый спирт, стеклянная палочка, концентрированная соляная кислота.
Для проведения работы, я делала раствор соли в этиловом спирте, а затем поджигала. Свой опыт я провела несколько раз, на последнем этапе были отобраны наилучшие образцы, поле чего мы сделали видео.
Выводы:
Летучие соли многих металлов окрашивают пламя в различные цвета, характерные для этих металлов. Окраска зависит от раскаленных паров свободных металлов, которые получаются в результате термического разложения солей при внесении их в пламя горелки. В моем случае к таким солям относились, фторид натрия и хлорид лития, они дали яркие насыщенные цвета.
Заключение.
Химический анализ используется человеком в очень многих областях, на уроках же химии мы знакомимся лишь с небольшой областью этой сложной науки. Приемы, которые используются в пирохимическом анализе, используются в качественном анализе как предварительное испытание при анализе смеси сухих веществ или как проверочные реакции. В качественном анализе реакции «сухим» путем играют только вспомогательную роль, их используют обычно в качестве первичных испытаний и проведения проверочных реакций.
Кроме того, данные реакции используются человеком и в других отраслях, к примеру в фейерверках. Как мы знаем, фейерверк это декоративные огни разнообразных цветов и форм, получаемые при сжигании пиротехнических составов. Так вот в состав фейерверка пиротехники добавляют разнообразные горючие вещества, среди которых широко представлены неметаллические элементы (кремний, бор, сера). В процессе окисления бора и кремния выделяется большое количество энергии, но не образуются газовые продукты, поэтому эти вещества применяются для изготовления взрывателей замедленного действия (чтобы воспламенить другие составы в определенное время). Многие смеси включают органические углеродсодержащие материалы. Например, древесный уголь (применяется в дымном порохе, снарядах для фейерверков) или сахар (дымовые гранаты). Используются химически активные металлы (алюминий, титан, магний), чье горение при высокой температуре дает яркий свет. Это их свойство стали использовать для запуска фейерверков.
В процессе работы, я поняла насколько сложно и важно работать с веществами, не все удалось в полной мере, как бы хотелось. Как правило, на уроках химии не хватает практикой работы, благодаря которой отрабатываются теоретические навыки. Проект помог мне развить этот навык. Кроме того, я с большим удовольствием познакомила, своих одноклассников с результатами своей работы. Это помогло им закрепить теоретический знания.
♣ Окрашивание пламени солями металлов
Соли некоторых элементов-металлов (* каких? ) при внесении в пламя окрашивают его. Это свойство можно использовать в качественном анализе для обнаружения катионов этих элементов в исследуемом образце.
Для проведения эксперимента требуется нихромовая проволочка. Ее следует промыть в конц. HCl и прокалить в пламени горелки. Если пламя при внесении проволочки окрашено, повторить обработку HCl.
Погрузить проволочку в раствор исследуемой соли и внести в пламя. Отметить окраску. После каждого опыта промывать и прокаливать проволочку до исчезновения окраски пламени.
Опыты по теме «Металлы I и II групп»
1. Окрашивание пламени
Проделать опыт по окрашиванию пламени хлоридами щелочных и щелочноземельных металлов. * Почему берут хлориды, а не другие соли?
Окрашивание пламени солями (слева направо): лития, натрия, калия, рубидия, цезия, кальция, стронция, бария.



(фото пламени калия – В.В. Загорский)
2. Горение магния на воздухе
Кусочек ленты магния взять тигельными щипцами и сжечь над фарфоровой чашкой. Доказать, что представляет собой продукт. * Как это сделать?
3. Взаимодействие магния с водой и кислотами
А) Налить в пробирку немного воды, добавить фенолфталеин и всыпать немного порошка магния. При необходимости нагреть пробирку. * Вспомните, как кальций взаимодействует с водой.
Б) Налить в одну пробирку 1 мл конц. HCl, а во вторую – 1 мл конц. HNO 3 . Поместить в каждую пробирку по кусочку ленты магния. * Какие продукты образуются? Как это можно доказать?

Опыты по теме «Алюминий»
1. Взаимодействие алюминия с кислотами и щелочами
Изучить в пробирках взаимодействие гранул алюминия с растворами:
|
на холоду |
при нагревании |
|
 |
 |
|
 |
||
 |
||
 |
||
|
конц. H 2 SO 4 |
Наблюдения оформить в виде таблицы.
* Вспомните, как алюминий реагирует с NaOH.
2. Гидроксид алюминия
Получить гидроксид алюминия в трех пробирках прикапыванием 1 М раствора аммиака к 1 мл раствора соли алюминия. Подействовать на гидроксид в первой пробирке избытком раствора аммиака, во второй – раствором HCl, в третьей – раствором NaOH. В раствор, полученный в третьей пробирке (* что представляет собой этот раствор? ), пропустить СО 2 . * Как и в каком приборе его получить?

3. Гидролиз солей алюминия
А) Определить рН раствора хлорида алюминия. * Объяснить результат с привлечением константы соответствующего процесса.
Б) К раствору хлорида алюминия прилить 1 М раствор карбоната натрия.
4. Алюминотермия (один из опытов, на выбор, проводится под тягой, в присутствии преподавателя )
А) Алюминотермическое получение хрома
В шамотовый тигель (или фунтик, сделанный из асбеста) поместить сухую однородную смесь 3 г порошка фторида кальция (* для чего он нужен? (фото В. Богданова)
Б) Алюминотермическое получение железа
В шамотовый тигель (или фунтик, сделанный из асбеста) поместить сухую однородную смесь 1,8 г оксида железа (III) и 0,5 г свеженапиленного порошка алюминия. Сделать посредине ямку, насыпать в нее 0,8 г перманганата калия. В середине кучки перманганата сделать с помощью пустой пробирки еще одну ямку. Тигель поместить в песчаную баню так, чтобы он весь находился в песке. Налить сверху немного глицерина так, чтобы он соприкасался только с перманганатом, но не с поверхностью реакционной смеси. По окончании реакции дать тиглю остыть, разбить его и извлечь «королек» железа.

Окрашивание пламени - фиолетовое, бб открытии калия по окраске пламени в присутствии натрия указано в главе о последнем.
Окрашивание пламени - карм и ново-красное.
Окрашивания пламени не дает.
Окрашивание пламени обусловлено перескоком электронов с орбит, более удаленных от ядра соответствующего атома, на более близкие к нему. Возбуждение осуществляется в данном случае за счет тепловой энергии пламени.
Окрашивание пламени в желтый цвет указывает на присутствие в веществе натрия.
Окрашивание пламени в желтый цвет указывает на присутствие в соли А натрия.
Окрашивание пламени в желтый цвет указывает на присутствие в веществе натрия.
Например, за счет теплоты пламени атомы натрия поглощают 200 8 кДж / моль теплоты, при этом происходит возбуждение атома и переход электронов на более высокие энергетические уровни.
Окрашивание пламени при внесении в него щелочных металлов или их соединений вызвано электронными переходами предварительно возбужденных атомов. При обратном переходе электронов возникает излучение, которое воспринимается в виде окраски пламени.
Окрашивание пламени применяется как проверочный способ для обнаружения бария. Соли бария и их растворы окрашивают пламя в желто-зеленый цвет.
Окрашивание пламени при внесении в него щелочных металлов или их соединений вызвано электронными переходами предварительно возбужденных атомов. При обратном переходе электронов возникает излучение, которое воспринимается в виде окраски пламени.
Окрашивание пламени солями кальция, стронция и бария производят с помощью чистой платиновой проволочки, смоченной растворами летучих солей этих металлов и внесенной в пламя спиртовки, поочередно.
Окрашивание пламени солями стронция и бария используется для получения сигнальных, или так называемых бенгальских огней.
Окрашивание пламени открытие ионов 58 прямые и обратные 80 разделение ионов 58 скорость 111 ел.
Окрашивание пламени газовой горелки соединениями металлов используется в качественном анализе для открытия катионов металлов, дающих излучение в видимой области спектра.
Если окрашивание пламени не обнаруживает присутствия натрия, то отделение от магния не является необходимым. Для открытия магния и калия при совместном их присутствии часть раствора испытывают на Mg посредством Na.
Для окрашивания пламени в составы вводят соединения некоторых металлов. При высокой температуре, развиваемой при горении составов, соединения металлов частично или полностью диссоциируют и, перейдя в парообразное состояние, дают спектр излучения. Каждый металл дает спектр особого, характерного для него цвета.
Наблюдается окрашивание пламени в фиолетовый цвет.
Реакции окрашивания пламени не дают возможности делаяъ подобных заключений, а сделать их бывает очень важно для того, чтобы выбрать наиболее подходящие методы количественного анализа вещества.
Реакции окрашивания пламени и получение окрашенных перлов проводят с небольшим количеством вещества, которое вносят на платиновой или нихромовой проволоке в пламя газовой горелки или паяльной трубки. Реакции разложения соли или возгонку проводят в пробирках из тугоплавкого стекла, в фарфоровых и металлических чашках или тиглях.
Реакции окрашивания пламени не дает.
Реакция окрашивания пламени не дает.
Реакция окрашивания пламени является высокочувствительной реакцией открытия натрия. Реакцию окрашивания пламени проводят так: вносят маленький кристаллик соли натрия на платиновой петле в бесцветное пламя горелки, которое при этом окрашивается в желтый цвет.
Реакции окрашивания пламени и получение окрашенных перлов проводят с небольшим количеством вещества, которое вносят на платиновой или нихромовой проволоке в пламя газовой горелки или паяльной трубки.
Причины окрашивания пламени до сих пор не выяснены. Однако это явление не вызывается горением SnH4, который, как полагали прежде, образуется в процессе восстановления соединений олова металлическим цинком.
Реакции окрашивания пламени и получение окрашенных перлов проводят с небольшим количеством вещества на платиновой или нихромовой проволоке, вносимой в пламя газовой горелки или паяльной трубки.
Причины окрашивания пламени до сих пор не выяснены. Однако это явление не вызывается горением SnH4, который, как полагали прежде, образуется в процессе восстановления соединений олова металлическим цинком.
По окрашиванию пламени в оранжево-красный цвет, если соединение кальция летучее.
По интенсивно-желтому окрашиванию пламени, которое исчезает при рассмотрении его через кобальтовое (синее) стекло.
Чем объясняется окрашивание пламени при введении солей ряда металлов.
Выполняя реакцию окрашивания пламени, на петле платиновой (или нихромовой) проволоки исследуемое вещество вносят в бесцветное пламя горелки.
Испытывают образец на окрашивание пламени, так как некоторые элементы, образующие летучие соединения, окрашивают пламя в характерный для них цвет, например барий - в желто-зеленый, натрий - в желтый.
Испытывают образец на окрашивание пламени, так как некоторые элементы, образующие летучие соединения, окрашивают пламя в характерный для них цвет, например барий - в желто-зеленый, натрий - в желтый.
При испытаниях на окрашивание пламени может случиться, что окраска, происходящая от одного из анализируемых элементов, присутствующего в большом количестве, будет маскировать окраску от других элементов.
Продукты разложения и химический состав исследуемого вещества. Для испытания на окрашивание пламени рекомендуется брать проволоку длиной 60 мм, диаметром 0 3 мм. Один конец этой проволоки сгибают в петлю диаметром 2 - 3 мм, другой ее конец тщательно впаивают в стеклянную палочку, которая служит ручкой. Проволока должна быть хорошо очищена многократным прокаливанием в наиболее горячей части несветящегося пламени горелки. Прокаливание чередуют с опусканием конца проволоки в концентрированную соляную кислоту.
Таллий открывают по окрашиванию пламени и спектральным методом, а также по образованию характерных кристаллов при действии на соли одновалентного таллия иодида калия, хлороплатината, хромата 13 ], тиосульфата , иодовисмутита [ 5J, мочевой кислоты , пикролоновой кислоты 17 ], по появлению характерной окраски при действии бензидина (или о-толуидина) на соли трехвалентного таллия.
Какие цветные реакции на окрашивание пламени могут быть выполнены для IV группы элементов.
Внешне проявляющееся в виде окрашивания пламени испускание нагретыми атомами щелочных металлов световых лучей обусловлено перескоком электронов с более высоких на более низкие энергетгческне уровни.