Качественная реакция на обнаружение белка. Контрольные вопросы для самоконтроля знаний, которые позволят судить о качестве усвоения изучаемого материала. Имеются ключевые слова
История химии в школьном курсе
РЕАКЦИЯ ПИОТРОВСКОГО (БИУРЕТОВАЯ РЕАКЦИЯ)
В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы:
Образующаяся группа –С(О)–NН– называется пептидной группой, связь С–N, соединяющая остатки млекул аминокислот, – пептидной связью.
При взаимодействии дипептида с новой молекулой аминокислоты получается трипептид и т. д.
Дикетопиперазины образуются при взаимодействии двух молекул аминокислот с отщеплением двух молекул воды:
Дикетопиперазины были выделены из белков Н.Д.Зелинским и В.С.Садиковым в 1923 г.
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи (биуретовая реакция).
Описание опыта. 2–3 мл раствора белка нагревают с 2–3 мл 20%-го раствора едкого кали или натра и несколькими каплями раствора медного купороса. Появляется фиолетовое окрашивание вследствие образования комплексных соединений меди с белками.
- РЕАКЦИЯ РУЭМАННА (НИНГИДРИНОВАЯ РЕАКЦИЯ (1911))
a -Аминокислоты реагируют с нингидрином, образуя сине-фиолетовый комплекс (пурпур Руэманна), интенсивность окраски которого пропорциональна количеству аминокислоты.
Реакция идет по схеме:
Реакция с нингидрином используется для визуального обнаружения a -аминокислот на хроматограммах (на бумаге, в тонком слое), а также для колориметрического определения концентрации аминокислот по интенсивности окраски продукта реакции.
Описание опыта. В пробирку наливают 1 мл 1%-го раствора глицина и 0,5 мл 1%-го раствора нингидрина. Содержимое пробирки осторожно нагревают до появления сине-фиолетового окрашивания.
- Реакция Сакагучи
Эта реакция на аминокислоту аргинин основана на взаимодействии аргинина с a -нафтолом в присутствии окислителя. Ее механизм еще полностью не выяснен. По-видимому, реакция осуществляется по следующему уравнению:
Поскольку производные хинониминов (в данном случае нафтохинона), у которых водород иминогруппы –NH– замещен на алкильный или арильный радикал, всегда окрашены в желто-красные тона, то, по-видимому, оранжево-красный цвет раствора при проведении реакции Сакагучи объясняется возникновением именно производного нафтохинонимина. Не исключена, однако, вероятность образования еще более сложного соединения за счет дальнейшего окисления оставшихся NH-групп аргининового остатка и бензольного ядра a -нафтола:
Описание опыта. В пробирку наливают 2 мл 0,01%-го раствора аргинина, затем добавляют 2 мл 10%-го раствора едкого натра и несколько капель 0,2% спиртового раствора a -нафтола. Содержимое пробирки хорошо перемешивают, приливают 0,5 мл раствора гипобромита и вновь перемешивают. Немедленно добавляют 1 мл 40%-го раствора мочевины для стабилизации быстро развивающегося оранжево-красного окрашивания.
- РЕАКЦИЯ ФОЛЯ
Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
- РЕАКЦИЯ С ФОРМАЛЬДЕГИДОМ
При взаимодействии a -аминокислот с формальдегидом образуются относительно устойчивые карбиноламины – N-метилольные производные, содержащие свободную карбоксильную группу, которую затем титруют щелочью:
Эта реакция лежит в основе количественного определения a -аминокислот методом формального титрования (метод Сёренсена).
Описание опыта. В пробирку наливают 5 капель 1%-го раствора глицина и прибавляют 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют равный объем 40%-го раствора формальдегида (формалин). Появляется красное окрашивание (кислая среда):
- РЕАКЦИЯ Циммермана
Это реакция на аминокислоту глицин.
Описание опыта. К 2 мл 0,1%-го раствора глицина, доведенного добавлением 10%-го раствора щелочи до рН = 8, приливают 0,5 мл водного раствора о-фталевого диальдегида. Реакционная смесь начинает медленно окрашиваться в ярко-зеленый цвет. Через несколько минут выпадает зеленый осадок.
- ОБРАЗОВАНИЕ КОМПЛЕКСОВ С МЕТАЛЛАМИ
a -Аминокислоты образуют с катионами тяжелых металлов внутрикомплексные соли. Со свежеприготовленным гидроксидом меди(II) все a -аминокислоты в мягких условиях дают хорошо кристаллизующиеся внутрикомплексные (хелатные) соли меди(II) синего цвета:
В таких солях ион меди координационными связями соединен с аминогруппами.
Описание опыта. В пробирку наливают 3 мл 3%-го раствора сульфата меди(II), добавляют несколько капель 10%-го раствора гидроксида натрия до образования голубого осадка. К полученному осадку гидроксида меди(II) приливают 0,5 мл концентрированного раствора глицина. При этом образуется темно-синий раствор глицината меди:
- КСАНТОПРОТЕИНОВАЯ РЕАКЦИЯ
Эта реакция используется для обнаружения a -аминокислот, содержащих ароматические радикалы. Тирозин, триптофан, фенилаланин при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные, имеющие желтую окраску. В щелочной среде нитропроизводные этих a -аминокислот дают соли, окрашенные в оранжевый цвет.
Описание опыта. В пробирку наливают 1 мл раствора тирозина и добавляют 0,5 мл концентрированной азотной кислоты. Смесь нагревают до появления желтой окраски. После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия до появления оранжевой окраски раствора:
- ОСАЖДЕНИЕ БЕЛКА СОЛЯМИ ТЯЖеЛЫХ МЕТАЛЛОВ
Описание опыта. В две пробирки наливают по 1–2 мл раствора белка и медленно, при встряхивании, добавляют по каплям в одну пробирку насыщенный раствор сульфата меди, а в другую – 20%-й раствор ацетата свинца. Образуются осадки труднорастворимых солеобразных соединений белка. Опыт иллюстрирует применение белка как противоядия при отравлении солями тяжелых металлов.
- Открытие аминного азота в белках
Описание опыта. В сухую пробирку помещают немного сухого белка, например желатины. Прибавляют пятикратное количество натронной извести (смесь едкого натра и гидроксида кальция), перемешивают встряхиванием и подогревают. Выделяется аммиак, вызывающий посинение розовой лакмусовой бумажки, смоченной водой. Одновременно ощущается запах жженого волоса, что всегда наблюдается при сжигании белковых веществ.
- Открытие серы в белках
Описание опыта. В пробирку наливают около ~0,5 мл раствора уксуснокислого свинца и прибавляют раствор едкого кали до растворения образовавшегося осадка гидроксида свинца. В другую пробирку наливают ~2–3 мл раствора белка и приливают такой же объем полученного раствора плюмбита. Нагревают смесь до кипения в течение 2–3 мин. Появление темного окрашивания указывает на образование сульфида свинца.
- РЕАКЦИЯ НА ПРИСУТСТВИЕ СЕРОСОДЕРЖАЩИХ a -АМИНОКИСЛОТ В БЕЛКЕ
Качественной реакцией на серосодержащие a -аминокислоты является реакция Фоля. Белки, содержащие остатки цистеина или цистина, также дают эту реакцию.
Описание опыта. В пробирку наливают 10 капель раствора яичного белка и вдвое больший объем 20%-го раствора гидроксида натрия. Содержимое пробирки нагревают до кипения (1–2 мин). К полученному щелочному раствору добавляют 5 капель раствора ацетата свинца(II) и вновь кипятят реакционную смесь. Наблюдается появление серо-черного осадка.
- РЕАКЦИЯ НА ТРИПТОФАН
Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
* * *
В ходе проведенного исследования мы выявили по литературным источникам имеющуюся информацию о цветных качественных реакциях на белковые аминокислоты; выполнили ряд перечисленных реакций и составили базу данных. Эта база может быть использована в школьной практике как в теоретическом плане, так и в практическом, т. к. мы приводим краткие, но подробные описания выполнения всех опытов.
Из предложенных 18 качественных реакций каждая практически осуществима в школьном курсе химии и имеет важное практическое значение. Сопровождение реакций химическими уравнениями конкретизирует и углубляет знания по биологической и органической химии, особенно знания учащихся специализированных биологических и химических классов.
Использованная литература
Ермаков А.Н., Арасимович В.В., Смирнова-Иконникова М.И., Мирри И.К. Методы биохимического исследования растений. М.,1952, 520 с.
Полянская А.С., Шевелева А.О. Методическая разработка по лабораторным работам: «Аминокислоты» и «Белки». Л., 1976, 37 с.
Пустовалова Л.М. Практикум по биохимии. 1999, 541 с.
Руководство к практическим занятиям по органической химии. Под ред. В.М.Родионова. М., 1954, 111 с.
Соловьев Н.А. Лабораторные работы по биологической химии. Методическая разработка. СПб., 1996, 70 с.
Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. М., 1982, 311 с.
З.Саитов,
С.В.Телешов, Б.Харитонцев,
секция «Юный химик» РХО им. Д.И.Менделеева (г.
Тобольск)
Реактивы: 2%-ный раствор аминоуксусной кислоты (глицина),
10%-ный раствор аминоуксусной кислоты, 1%-ный раствор аминоуксусной кислоты, растворы индикаторов в капельницах: метиловый оранжевый, метиловый красный, лакмус, 40%-ный раствор формальдегида (формалин) – нейтрализованный, оксид меди (II), 10%-ный раствор гидроксида натрия, 10%-ный раствор нитрита натрия, ледяная уксусная кислота, 0,1%-ный раствор нингидрина, натрий металлический, -капролактам.
Оборудование: химические стаканы (100 мл), лёд, фильтровальная бумага, пинцеты, скальпели, бани песчаные, термометры (300 °С).
Отношение моноаминомонокарбоновых кислот к индикаторам. В три пробирки наливают по 1 мл 2%-ного раствора аминоуксусной кислоты (глицина) и добавляют по 2 капли растворов индикаторов: в одну пробирку – метилового оранжевого, в другую – метилового красного, в третью – лакмуса.
Меняется ли окраска индикаторов? Объясните результаты опыта.
Реакция аминоуксусной кислоты с формальдегидом. В пробирку к 2 мл 2%-ного раствора аминоуксусной кислоты прибавляют 1 каплю индикатора метилового красного. Раствор окрашивается в жёлтый цвет. Этот индикатор применяют для обнаружения в растворах кислот: в кислой среде в интервале рН 4,2 – 6,2 жёлтая окраска индикатора меняется на красную. Водный раствор аминоуксусной кислоты имеет нейтральную реакцию.
К раствору аминоуксусной кислоты добавляют 1 мл нейтрализованного формалина. Жёлтая окраска раствора превращается в красную, следовательно, реакция раствора стала кислой. Формальдегид присоединяется к аминогруппам, связывает их, карбоксильные группы при этом освобождаются и обусловливают кислую реакцию раствора.
Уравнения реакций аминоуксусной кислоты с 1 моль формальдегида (образование N-монооксиметиламиноуксусной кислоты) и с 2 моль формальдегида (образование N, N-диоксидиметиламиноуксусной кислоты):

Образование медной соли аминоуксусной кислоты. В пробирке нагревают при встряхивании смесь 0,5 г оксида меди (II) и 2 – 3 мл 2%-ного раствора аминоуксусной кислоты. Через 2 – 3 мин пробирку ставят в штатив. После отстаивания хорошо видна синяя окраска раствора. Отливают примерно 0,5 мл раствора и добавляют к нему 1 – 2 капли
10%-ного раствора гидроксида натрия.
Выпадает ли осадок гидроксида меди (II)?
Остальную жидкость сливают с осадка оксида меди (II) в пробирку и охлаждают в стакане с ледяной водой. Постепенно выпадают кристаллы труднорастворимой медной соли аминоуксусной кислоты. Образование комплексных окрашенных в синий цвет медных солей характерно для
-аминокислот.
Уравнение реакции образования комплексной медной соли аминоуксусной кислоты следующее:

Реакция аминокислот с азотистой кислотой. Аминокислоты, как и первичные амины, реагируют с азотистой кислотой с выделением азота. Эту реакцию используют для количественного определения аминокислот.
К 2 мл 10%-ного раствора аминоуксусной кислоты приливают 2 мл
10%-ного раствора нитрита натрия и 2 капли ледяной уксусной кислоты. При встряхивании содержимого пробирки обильно выделяются пузырьки газа (азота).
Уравнение реакции аминоуксусной кислоты c азотистой кислотой следующее:

Реакция -аминокислот с нингидрином. Реакцию с нингидрином применяют для качественного и количественного анализа -аминокислот. Нингидрин разлагает -аминокислоты на альдегиды, оксид углерода (IV) и аммиак. Аммиак конденсируется с избытком нингндрина и с продуктами его восстановления. Продукты конденсации окрашены в розово-фиолетовый цвет. Различные -аминокислоты образуют окрашенные соединения, отличающиеся оттенком.
К 2 мл 1%-ного раствора аминоуксусной кислоты приливают 2 – 3 капли 0,1%-ного раствора нингидрина. Содержимое пробирки встряхивают и ставят в штатив. Через некоторое время раствор приобретают фиолетовый цвет с синеватым оттенком.

нингидрин
^ Свойства шерсти и синтетических волокон
Реактивы: азотная кислота концентрированная, 25%-ный раствор серной кислоты (= 1,18), 10%-ный раствор гидроксида натрия, ацетон.
Материалы, оборудование: волокна (или кусочки ткани); шерсть, капрон, лавсан, нитрон, хлорин; тигельные щипцы.
Ход исследования. В четыре пробирки наливают по 1,5 – 2 мл: концентрированной азотной кислоты, 25%-ного раствора серной кислоты,
10%-ного раствора гидроксида натрия, ацетона. В каждую пробирку помещают небольшое количество шерстяного волокна (или ткани). Размешивают содержимое пробирок стеклянными палочками и оставляют в штативе. Через 2 – 3 мин отмечают изменения, которые произошли с образцами шерсти.
Опыт повторяют, но вместо шерсти в пробирки вносят волокна (или ткань) из капрона, лавсана, нитрона.
Образцы волокон (или ткани) помещают на асбестовую сетку и осторожно нагревают. Отмечают происходящие изменения, запах продуктов горения, характер пепла.
Результаты всех опытов записывают в таблицу:
| Волокно | Отношение к |
||||
| HNO 3 конц. | 25%-ной H 2 SO 4 | 10%-ному NaOH | ацетону | нагреванию |
|
| Шерсть | |||||
^
Цветные рекции на белки
Цветные реакции на белки являются реакциями на структурные элементы белка – аминокислоты, а также на характерные связи в белковой молекуле. Эти реакции позволяют выявить ряд аминокислот, входящих в состав молекулы данного белка.
^ Биуретовая реакция
Реактивы: раствор белка, 1%-ный; едкий натр, 10%-ный; сернокис- лая медь, 2%-ная.
Ход исследования. В пробирку наливают 1 мл раствора белка, прибавляют равный объём 10%-ного едкого натрия, хорошо перемешивают и добавляют 1 – 2 капли 2%-ного раствора сернокислой меди. Встряхивают. Жидкость окрашивается в фиолетовый цвет, так как в результате реакции образуется комплексное соединение фиолетового цвета.
Для протекания реакции необходимо наличие по крайней мере двух пептидных связей, а простейшим соединением для этого является биурет – продукт имидизации двух молекул мочевины.
^ Ксантопротеиновая реакция
Реактивы: раствор белка, 1%-ный; азотная кислота концентрированная; аммиак, концентрированный раствор.
Ход исследования. В пробирку наливают 1 мл 1%-ного раствора белка, добавляют 0,5 мл концентрированной азотной кислоты и осторожно нагревают. Осадок белка, образующийся после добавления кислоты, медленно растворяется и приобретает жёлтый цвет. Пробирку охлаждают и осторожно прибавляют 1 мл концентрированного раствора аммиака. Жёлтая окраска переходит в оранжевую.
^ Реакция на триптофан (реакция Шульце-Распайля)
Реактивы: раствор белка, 1%-ный; сахароза, 10%-ный раствор; серная кислота, концентрированная.
Ход исследования. В пробирку наливают 1 мл 1%-ного раствора белка, добавляют 1 – 2 капли 10%-ного раствора сахарозы и по стенкам подслаивают 1 мл концентрированной серной кислоты, не допуская смешивания жидкостей. На границе двух жидкостей появляется вишнёво-красное окрашивание.

^ Реакция Адамкевича
Реактивы: раствор белка, 1%-ный; уксусная кислота, ледяная; сер- ная кислота, концентрированная.
Ход исследования. В пробирку наливают 1 мл 1%-ного раствора белка, добавляют 1,5 мл ледяной уксусной кислоты и слегка подогревают. После этого жидкость охлаждают и очень осторожно по стенке подслаивают 1 мл концентрированной серной кислоты так, чтобы жидкости не смешивались. При стоянии на границе соприкосновения двух слоёв жидкости возникает красно-фиолетовое окрашивание в виде кольца.

триптофан
^ Реакция на серусодержащие аминокислоты
Реактивы: раствор белка, 1%-ный; едкий натр, 30%-ный; плюмбит натрия Na 2 PbO 2 (раствор плюмбита натрия готовится добавлением едкого натрия к раствору уксуснокислого свинца до растворения образующегося вначале осадка гидроксида свинца).
Ход исследования. В колбу наливают 2 – 3 мл 1%-ного раствора белка, прибавляют равный объём 30%-ного раствора едкого натрия и нагревают до кипения. Полученную щелочную жидкость охлаждают и используют для дальнейших реакций.

Цистеин
^ Реакция Фоля на серусодержащие аминокислоты
В пробирку наливают 0,5 мл щелочной жидкости и прибавляют равный объём раствора плюмбита натрия. Появляется жёлто-коричневое или чёрное окрашивание (в зависимости от количества серы в белке), которое усиливается при нагревании, или же выпадает чёрный осадок сернокислого свинца.
^
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
Петров, А. А. Органическая химия [Текст] : учебник / А. А. Петров, Х. В. Бальян, А. Т. Трощенко; под ред. М. Д. Стадничука. - 5-е изд., перераб. и доп. - СПб. : «Иван Фёдоров», 2002. - 624 с. : ил.
Ким, А. М. Органическая химия [Текст] : учеб. пособие / А. М. Ким. - 3-е изд., испр. и доп. - Новосибирск: Сиб. унив. изд-во, 2002. - 971 с.
Филиппович, Ю. Б. Основы биохимии [Текст] : учебник / Ю. Б. Филиппович. - 4-е изд. , перераб. и доп. - М. : Агар; СПб. : Флинта, 1999. - 512 с. : ил.
Биохимия [Текст] : учеб. для вузов / под ред. Е. С. Северина. - 4-е изд., испр. - М. : ГЭОТАР-МЕДИА, 2005. - 784 с. : ил.
Комов, В. П. Биохимия [Текст] : учебник / В. П. Комов, В. Н. Шведова. - 2-е изд., испр. - М. : Дрофа, 2006. - 640 с. : ил.
Северин, Е. С. Биохимия [Текст]: учебник / Е. С. Северин, Т. Л. Алейников, Е. В. Осипов. - М. : Медицина, 2000. - 168 с. : ил.
Овчинников, Ю. А. Биоорганическая химия [Текст] / Ю. А. Овчинников. - М. : Просвещение, 1987. - 815 с. : ил.
Проскурина, И. К. Биохимия [Текст] : учеб. пособие / И. К. Проскурина. - М. : ВЛАДОС-ПРЕСС, 2003. - 240 с. : ил.
Грандберг, И. И. Органическая химия [Текст] : учебник / И. И. Грандберг. - 5-е изд., стер. - М. : Дрофа, 2002. - 672 с. : ил.
Тюкавкина, Н А. Биоорганическая химия [Текст] : учеб. для студентов мед. вузов / Н. А. Тюкавкина, Ю. И. Бауков, С. Э. Зурабян. – М. : ГЭОТАР-Медиа, 2009. - 411 с. : ил.
Биохимия [Текст] : краткий курс с упражнениями и задачами / под ред. Е. С. Северина, А. Я. Николаева. - М. : ГЭОТАР-МЕД, 2001. - 448 с. : ил.
Руководство к лабораторным занятиям по органической химии [Текст] : учеб. пособие / под ред. Н. А. Тюкавиной. - 2-е изд. , перераб. и доп. - М. : Дрофа, 2002. - 384 с. : ил.
Чиркин, А. А. Практикум по биохимии [Текст] : учеб. пособие / А. А. Чиркин. - Минск: Новое знание, 2002. - 512 с.
Кольман, Я. Наглядная биохимия [Текст] : пер. с нем. / Я. Кольман, К. -Г.Рем. - М. : Мир, 2000. - 470 с.
Остерман, Л. А. Методы исследования белков и нуклеиновых кислот [Текст]: пособ. для студентов / Л. А. Остерман. - М. : МЦНМО, 2002. - 248 с. : ил.
Практикум по общей и биоорганической химии [Текст] : учеб. пособие / под peд. В. А. Попкова. - 2-е изд., испр. - М. : Академия, 2007. - 234 с. : ил.
Учебное издание
Хитрин Сергей Владимирович
Колотилова Нина Викторовна
Биоорганическая химия
в технологии защиты биосферы
Лабы по биохимии 1.doc
Тема: БелкиКАЧЕСТВЕННЫЕ ЦВЕТНЫЕ РЕАКЦИИ НА ФУНКЦИОНАЛЬНЫЕ ГРУППЫ БЕЛКОВ И АМИНОКИСЛОТ.
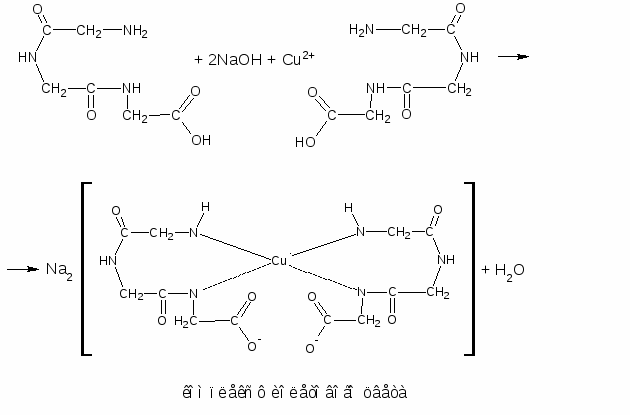
Биуретовая реакция на пептидную группу (реакция Пиотровского)
Метод основан на способности пептидной группы в белках и полипептидах (-CO-NH-) образовывать в щелочной среде с ионами меди комплексное соединение фиолетового цвета с красным или синим оттенком в зависимости от числа пептидных связей в белке.
Биуретовая реакция положительна с белками и пептидами имеющими не менее двух пептидных связей.С ди- и трипептидами она не устойчива.
Биуретовую реакцию дают небелковые вещества, содержащие не менее двух пептидных групп, например, производное мочевины - биурет NH2-CO-NH-CO-NH2, давшее название этой реакции, и некоторые другие.
В сильнощелочной среде пептидные группы полипептидов переходят в енольную форму, в которой и взаимодействуют с ионами меди, образуя окрашенный биуретовый комплекс. Биуретовая реакция схематично протекает так:
R1 O H R3 O H R5
H R2 OH H R4 OH
H2N CH C N CH C N CH C N CH C N CH …
R1 OH R2 H R3 OH H R5
Енольная форма полипептида
H2N CH C N CH C N
R1O O
CH N C CH N C ONa
R5 ONa R4
Комплекс фиолетового цвета
Нингидриновая реакция на α-аминогруппу
Эта реакция обусловлена наличием в аминокислотах аминогруппы в α-положении. Белки, полипептиды и аминокислоты образуют при кипячении с нингидрином соединение синего или сине-фиолетового цвета. Нингидриновая реакция является одной из наиболее чувствительных для обнаружения α-аминогрупп.
Сущность реакции заключается в том, что а-аминокислоты и пептиды, реагируя с нингидрином, подвергаются окислительному дезаминированию и декарбоксилированию. В зависимости от среды образуются различные продукты реакции. Механизм реакции сложен, но схематично его можно изобразить следующим образом:

^ Ксантопротеиновая реакция на ароматическое кольцо аминокислот
Метод основан на способности аминокислот и аминокислотных остатков полипептидов, содержащих ароматическое кольцо, образовывать при взаимодействии с концентрированной азотной кислотой динитропроизводные желтого цвета. В щелочной среде они переходят в хиноидные структуры, имеющие оранжевое окрашивание. Ксантопротеиновая реакция характерна для фенилаланина, тирозина, триптофана, имеющих ароматическое (бензольное) кольцо. Например, в реакции с тирозином образуется динитротирозин; добавление гидроксида натрия приводит к образованию натриевой соли хиноидной структуры динитротирозина:

Тирозин Желтое нитросоединение
^
Реакция Шульце-Распайля на триптофан
Фруктоза в присутствии конц. H 2 SO 4 теряет 3 молекулы воды и превращается в оксиметилфурфурол, который образует с триптофаном окрашенные продукты конденсации. Реакцию можно проводить как с фруктозой, так и с сахарозой, при гидролитическом расщеплении которой освобождаются равные количества фруктозы и глюкозы.
^
Реакция Адамкевича на триптофан
.
При нагревании триптофан взаимодействует с глиоксиловой кислотой с образованием соединения, окрашенного в красно-фиолетовый цвет.
Для проведения реакции используют ледяную уксусную кислоту, в которой как примесь содержится глиоксиловая кислота. В качестве водоотнимающего средства используется конц. H 2 SO 4 .
^ Реакция Сакагучи на аргинин

^ Реакция Фоля на серосодержащие аминокислоты.
Известны 3 серосодержащие аминокислоты: цистеин, цистин и метионин. В молекулах цистеина и цистина сера связана относительно слабо и легко отщепляется при щелочном гидролизе в виде сероводорода, который реагирует со щелочью, образуя сульфиды натрия или калия. Последние взаимодействуют с уксуснокисльм свинцом с образованием осадка сернистого свинца черного или буро-черного цвета. Реакция протекает по следующим уравнениям:

^ Реакция Паули на гистидин и тирозин
При взаимодействии сульфаниловой кислоты в среде с нитритом натрия(калия) проходит реакция диазотирования и образуется диазобензолсульфоновая кислота, которая в реакции с гистидином (или тирозином) образует комплексное соединение вишневого цвета (азокраситель).
^
РАЗДЕЛЕНИЕ БЕЛКОВЫХ СМЕСЕЙ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ.
Белки как вещества высокомолекулярные образуют коллоидные растворы. Растворимость белков в воде определяется наличием гидрофильных групп (несущих заряд или незаряженных) в аминокислотах, входящих в состав белка. Имеют также значение наличие у молекул одноименного суммарного заряда и форма молекул (отношение длинной и короткой осей). Воздействия, влияющие на гидратацию, заряд или форму белковых молекул, изменяют и ее растворимость.
^ Высаливание белков
Высаливание - обратимая реакция осаждения белков из растворов с помощью больших концентраций нейтральных солей (NаС1)
При высаливании происходит дегидратация макромолекул белка и устранение заряда. На процесс высаливания влияет ряд факторов: гидрофильность белка, его относительная молекулярная масса, заряд, в связи с чем для высаливания различных белков требуется разная концентрация одних и тех же солей. Альбумины осаждаются в насыщенном растворе, а глобулины - в полунасыщенном так как у них относительная масса больше, чем у глобулинов.
Высаливание белков является обратимой реакцией, так как осадок белка может вновь растворяться после уменьшения концентрации солей путем диализа или разведения водой.
^ РЕАКЦИИ ОСАЖДЕНИЯ БЕЛКОВ.
Денатурация белков (необратимое осаждение) сводится к разрушению структуры белка и потере им биологических свойств. При необратимых реакциях осаждения белки претерпевают глубокие изменения и не могут быть растворены в первоначальном растворителе. К необратимым реакциям относятся осаждение белка солями тяжелых металлов, минеральными и органическими кислотами, алкалоидными реактивами и осаждение при кипячении.
^ Осаждение белков спиртом, ацетоном.
Осаждение белков солями тяжелых металлов
Белки легко осаждаются солями металлов (свинца, меди, серебра, ртути и др.). образуя с ними прочные солеобразные и комплексные соединения. В отличие от высаливания солями щелочных и щелочноземельных металлов для осаждения солями тяжелых металлов требуются небольшие концентрации последних. В случае применения уксуснокислого свинца и СuSO4 избыток солей вызывает растворение образованного ими осадка. Такое растворение вызывается адсорбцией избытка ионов металла и перезарядкой белкового комплекса, вследствие чего в раствор переходит комплекс измененного белка с металлом. Благодаря тому же механизму добавление достаточного количества хлористого натрия вызывает растворение ртутного соединения белка. Белковые осадки, полученные действием солей тяжелых металлов, однако, нерастворимы в первоначальном "растворителе, т.е. в воде или слабых растворах солей.
Таким образом, осаждение белков солями тяжелых металлов следует отнести к необратимым реакциям осаждения, связанным с денатурацией белка. Осадки от солей тяжелых металлов, как правило, нерастворимы даже после удаления солей диализом или растворения водой. Свойством белков связывать тяжелые металлы пользуются в медицинской практике, употребляя белки (молоко, яйца) как противоядие при отравлении солями ртути (сулема), свинца (от недоброкачественной посуды) или меди (от окисления медной посуды), пока эти соли не успели всосаться. Реакции осаждения белков солями тяжелых металлов идут обычно полно (особенно в присутствии щелочных металлов), и ими пользуются не только для выделения белков из раствора, но и для освобождения жидкостей от белков.
^
Осаждение белков минеральными кислотами.
Концентрированные минеральные кислоты вызывают необратимое осаждение белков из растворов. Это осаждение объясняется как явлением дегидратации белковых частиц, так и рядом других причин (например, образование комплексных солей белка с кислотами и др.). Избыток минеральной кислоты, за
исключением азотной, растворяет выпавший осадок белка.
^
Осаждение белков алкалоидными реактивами
Растворы белков могут образовывать осадки при добавлении так называемых алкалоидных реактивов. К последним относятся таннин, пикриновая кислота, некоторые другие вещества. Эта способность белков к осаждению алкалоидными реактивами объясняется наличием сходных азотистых группировок как в белках, так и в алкалоидах. Механизм осаждения алкалоидными реактивами заключается в образовании нерастворимых солеобразных соединений с азотистыми основными группами. В этом соединении белок является катионом, алкалоидный реактив - анионом. Вследствие этого осаждение белков алкалоидными реактивами необходимо проводить в кислой среде (частицы белка перезаряжаются и переходят в состояние катионов). В щелочной среде осадки растворяются. Протамины и гистоны осаждаются в нейтральной среде.
^
Осаждение белков органическими кислотами
Белки из растворов могут осаждаться органическими кислотами. Однако разные органические кислоты неодинаково действуют на белок. ТХУ, сульфосалициловая кислота являются очень чувствительными и специфическими реактивами на белок, широко применяются с этой целью. Осаждение белков с помощью трихлоруксусной кислоты (ТХУ) в конечной концентрации 2,5-5% часто применяется для полного удаления белка из биологических жидкостей (например, из сыворотки крови), т.к. ТХУ осаждает только белки, а продукты их распада остаются при этом в растворе. Это особенно важно, когда нужно определить отдельно содержание азота белка и азота более низкомолекулярных продуктов: аминокислот, мочевины и др. - так называемый "небелковый азот". В этом случае, если после осаждения белков требуется из фильтрата удалить ТХУ, то это достигается его кипячением, в результате чего ТХУ разлагается на хлороформ и угольный ангидрид, которые улетучиваются.
^
Осаждение белков при нагревании.
Почти все белки свертываются при нагревании. Температура свертывания различна для разных белков, и если одни белки коагулируют уже при 50-55°С, то некоторые из них выдерживают даже продолжительное кипячение. При свертывании белки денатурируют и переходят в нерастворимое состояние.
Механизм тепловой денатурации связан с перестройкой структуры белковой молекулы, в результате чего белок теряет свои нативные свойства и растворимость. Реакция денатурации протекает постепенно и ускоряется с повышением температуры, поэтому слишком кратковременное нагревание может и не привести к свертыванию. Присутствие солей и концентрация водородных ионов играют важную роль в свертывании белков при нагревании. Наиболее полная и быстрая коагуляция имеет место в изоэлектрической точке, т.е. при таком рН, когда коллоидные частицы белка теряют свой электрический заряд и становятся наименее устойчивыми в растворе. Для. большинства белков изоэлектрическая точка соответствует слабокислой реакции (рН около 5). В сильно кислых растворах мицеллы перезаряжаются и несут положительный заряд, что повышает их устойчивость. Подобно этому в щелочных растворах стабильность белкового коллоида обусловлена отрицательным зарядом частицы. Поэтому в сильнокислых растворах белки при нагревании могут коагулировать лишь при добавлении достаточного количества какой-либо нейтральной соли.
^ ОПРЕДЕЛЕНИЕ ИЗОЭЛЕКТИЧЕСКОЙ ТОЧКИ БЕЛКА.
Белки следует рассматривать как вещества, содержащие большое количество кислотных и основных групп. Кислотные группы белка происходят главным образом за счет карбоксильных групп дикарбоновых кислот. Кислую реакцию дают также фенольные, гидроксильные и сульфгидрильные группы. Щелочные, или основные, группы белка обязан аминнным, гуанидиновым и имидным группам аминокислот. На кислотно-щелочтл-ге свойства белка влияет также характер соединения остатков концевых аминокислот в белковой молекуле. Обладая одновременно кислотными и основными свойствами, белки образуют биполярные ионы.
В щелочных растворах белок играет роль аниона. При потере протона из группы -NНз, например, при действии NаОН, образуется натриевая соль белка (протеинат натрия).
В кислых растворах, наоборот, белок играет роль катиона, например, с соляной кислотой получается хлористоводородная соль (протеинхлорид).
Таким образом, фактором, определяющим поведение белка как аниона или катиона, является концентрация водородных ионов. Ее повышение (кислая среда) уменьшает кислотную диссоциацию белка и переводит его в катион, понижение концентрации водородных ионов, наоборот, подавляет щелочную диссоциацию и переводит белковые частицы в анионы. Однако при определенном значении рН (неодинаковым для различных белков) кислотная диссоциация белковой части становится равной щелочной - число положительных зарядов амфотерного иона.
Сравнивается с числом отрицательных зарядов и заряд в целом может стать близким или практически равным нулю. В этих условиях белок находится в изоэлектрическом состоянии и в электрическом поле не будет обнаруживать передвижение ни к катоду, ни к аноду. рН раствора, при которой белок находится в изоэлектрическом состоянии, называется изоэлектрической точкой белка. В этой точке белок находится почти целиком в виде амфотерных ионов, несущих равные положительный и отрицательный заряды, тогда как при других концентрациях водородных ионов у белка имеется преимущественно положительный или отрицательный заряд. Растворы белков в изоэлектрической точке наименее устойчивы. В этом случае отталкивание одноименно заряженных частиц, повышающее устойчивость раствора, прекращается и в качестве стабилизирующего фактора действует лишь гидратная (водная) оболочка белка. Для большинства белков изоэлектрическая точка близка к нейтральной среде, но немного сдвинута в кислую сторону. Это объясняется тем, что кислотные свойства у них преобладают над щелочными и в нейтральной среде они реагируют как слабые кислоты. Молекула таких белков содержит больше свободных карбоксильных групп, чем амидных, а при гидролизе дает преобладание дикарбоновых и других кисло-реагирующих групп над теми, у которых преобладают основные свойства. Некоторые белки, наоборот, относительно богаче аминными группами и в своем составе содержат больше остатков диаминокислот. В нейтральном растворе они ведут себя как слабые основания. Такие белки (например, гистоны и протамины) имеют изоэлектрическую точку при слабощелочной среде реакции.
Определение изоэлектрической точки удобно произвести на примере желатина.
| № | кол-во 0,2М р-ра | кол-во 0,1М р-ра | рН | добавление 1% | добавлено | степень |
| пробирок | Na 2 HPO 4 (мл.) | лимонной к-ты (мл.) | смеси | р-ра яичного альбумина | спирта этилового | мутности |
| 1 | 0.25 | 0,75 | 3,2 | 0,5 | 2 | - |
| 2 | 0,34 | 0,66 | 3,7 | 0,5 | 2 | - |
| 3 | 0.41 | 0,59 | 4,2 | 0,5 | 2 | |
| 4 | 0.48 | 0,52 | 4,7 | 0,5 | 2 | - |
| 5 | 0.54 | 0,46 | 5,2 | 0,5 | 2 | |
| 6 | 0.66 | 0,34 | 5,7 | 0,5 | 2 | - |
^ ГРУППОВЫЕ РЕАКЦИИ НА УГЛЕВОДЫ
Проба с -нафтолом.
Реакция является одной из наиболее чувствительных общих реакций на углеводы и углеводные компоненты в сложных соединениях. Углеводы с -нафтолом дают фиолетовое окрашивание. Обусловлено оно тем, что при взаимодействии с концентрированной серной кислотой углеводы образуют фурфурол или 5-оксиметилфурфурол, которые конденсируются с нафтолом. Получившееся вещество окисляется в серной кислоте, образуя окрашенное хиноидное соединение.
Реакция с антроном
Фурфурол или 5-оксиметилфурфурол, образующиеся при действии серной кислоты на сахар, конденсируясь с антроном, дают соединения, окрашенные в синий или зеленый цвет.
Реакция Троммера
Реакция является пробой на редуцирующие сахара. Способностью окисляться в щелочной среде с восстановлением солей меди (II) в соли меди (I) обладают так называемые редуцирующие (восстанавливающие) моносахариды и дисахариды, содержащие в своей молекуле свободную карбонильную группу, которая при этом окисляется до карбоксильной.
Реакция Барфеда
Отличие от предыдущих реакций восстановления в том, что окисление сахароз протекает не в щелочной среде, а в среде, близкой к нейтральной. В этих условиях редуцирующие дисахариды в противоположность моносахаридам практически не окисляются, что позволяет отличить их от моноз.
Реакция Селиванова.
Реакция является пробой на кетозы 5-оксиметилферфурол, образующийся при нагревании кетогексоз с сильными кислотами (НСl), дает с резорцином вишнево- красное окрашивание. Реакцию с резорцином дают как свободные кетогексозы, так и отщепляющиеся от более сложных Сахаров (из сахарозы, например). Альдозы также могут образовывать 5-оксиметилфурфурол, но при этом требуется длительное нагревание.
Реакция на пентозы.
При нагревании с концентрированной соляной или серной кислотами пентозы теряют три молекулы воды и превращаются в фурфурол. Фурфурол - бесцветная жидкость, которая с анилином дает характерный продукт конденсации красного, с орцином - зеленого, с флороглицином - вишневого цвета.
Реакция Мальфаттн
Реакция является качественной пробой на лактозу. Химизм не ясен.
Ход работы: 1 мл исследуемого р-ра смешивают с 2 каплями NаОН и 0,5 мл аммиака. Смесь помещают на 15 мин . в водяную баню. В присутствии лактозы появляется оранжево-красное окрашивание.
Проба на сахарозу
Качественная реакция на сахарозу с солями кобальта.
Ход работы: В пробирку с 2 мл сахарозы добавляют 1 мл 5% р-ра NаОН и несколько капель 2% р-ра Со(NОз)2. Раствор приобретает фиолетовое окрашивание.
Проба на полисахарнды
При взаимодействии полисахаридов с йодом имеют место различные процессы: комплексообразованпе. адсорбция и пр. Оттенок окрашивания зависит от строения полисахарида, в частности, от степени его ветвления.
Для получения йодосорбционного соединения крахмала необходимо наличие свободного йода. NаОН превращает свободный йод в йодное, гипойодное и податное соединение, которое после прибавления кислоты разлагается с выделением свободного йода. Поэтому прежде чем приступить к йодной пробе, щелочные растворы надо нейтрализовать.
Реакция связывания свободного йода в щелочной среде:
1) J2 2NaOHNaJ NaJO H2O
2) NaJONaJO3 NaJ
В кислой среде при нейтрализации:
2NaJ Na2SO3 6HCl3J2 6NaCl 3H2
^ КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ САХАРА В БИОЛОГИЧЕСКОЙ ЖИДКОСТИ ОРТО-ТОЛУИДИНОВЫМ МЕТОДОМ
Глюкоза при нагревании с о-толуиднном в растворе уксусной кислоты дает зеленое окрашивание, интенсивность которого пропорциональна содержанию глюкозы. Содержание глюкозы определяют в жидкости, из которой предварительно удаляют белок.
Ко всем 0,5 мл. из каждой пробирки добавить по 2 мл . орто-толуидинового реактива.
Пробирку 1` прокипятить в водяной бане в течении 8 минут.
Содержимое пробирки 1` колориметрировать на ФЭК против контрольной 2` пробы
(α = 620-640 нм ., кювета 0,5 см .)
Cоп = (Cст*Eоп)/Eоп = мг/мл
Соп – с(С6Н6О6) в исследуемой жидкости
Сст – с(С6Н6О6) в стандартной пробе
Еоп и Ест – оптическая плотность опытной и стандартной пробы
^ Тема: ЛИПИДЫ
АЦИЛГЛИЦЕРИНЫ
Акролеиновая проба
Кроме того, что жиры дают характерное масляное пятно, например, на бумаге, реакцией на присутствие жира может служить так называемая акролеиновая проба.
Акролеиновой пробой открывается в жирах остаток глицерина, который при нагревании жира частично переходит в свободный глицерин. Глицерин теряет воду и образует ненасыщенный альдегид - акролеин, легко обнаруживаемый по специфическому раздражающему запаху.

Акролеин может образовываться при пережевывании пищи, и от его присутствия в значительной мере зависит резкий, удушливый запах кухонного чада. Акролеиновую пробу проводят, нагревая жир в присутствии бисульфита калия или натрия (в качестве водоотнимающего средства). Липиды, не содержащие глицерин (воск, жирные кислоты, стерины и т.д.), акролеиновой пробы не дают.
Растворение жиров,
Обычно липиды извлекают из высушенных тканей органическими растворителями. Для разделения липидов пользуются неодинаковой растворимостью их в различных растворителях: одни из них хорошо растворимы в эфире, но плохо в ацетоне (фосфолипиды), другие растворимы в бензоле, но нерастворимы в спирте (холестерол и др.).
Эмульгирование жиров.
В виду плохой растворимости в воде липиды образуют эмульсии с бифильными молекулами - белками, детергентами, желчью.
Гидролиз жира (омыление).
Ход работы: В пробирку наливают около 2 мл растительного масла и добавляют равный объем 40% р-ра едкого калия. Пробирку закрывают пробкой, в которую вставлена стеклянная трубочка (холодильник), помещают в кипящую водяную баню и держат там до образования однородного раствора мыла. Результат опыта и уравнение реакции записывают.
В пробирку наливают примерно 8-10 мл воды и взбалтывают. Полученный раствор используют для определения составных частей жира.
Открытие в гидролизате составных частей жира.
Открытие жирных кислот.
Ход работы: В пробирку наливают часть полученного в четвертом опыте гидролизата и добавляют равное количество 10 %-ного раствора серной кислоты. Пробирку опускают в кипящую водяную баню до образования на поверхности жидкости жирного слоя.
^ Открытие глицерина
Ход работы: В пробирку наливают примерно 2 мл гидролизата, добавляют 8-10 капель 10 % р-ра едкого натра и несколько капель 2% р-ра сернокислой меди. Появляется слабо-синее окрашивание, вследствие образования глицерата меди.
Результаты обеих реакций записывают.
^ Открытие ненасыщенных жирных кислот в жире.
Ход работы: В 2 пробирки наливают по 1 мл бромной воды. В первую пробирку добавляют несколько капель растительного масла и тщательно встряхивают; наблюдают обесцвечивание бромной воды. Вторая пробирка служит контролем. Результаты опыта и уравнение реакции записывают.
^
Получение нерастворимых солей высших жирных кислот
Ход работы: В пробирку наливают 1-2 мл раствора мыла (можно использовать
Гидролизат, полученный в 4 опыте) и прибавляют несколько капель 10 % р-ра хлористого кальция. Тщательно перемешивают и наблюдают появление осадка нерастворимого кальциевого мыла. Результат опыта и уравнение реакции записывают.
Определение йодного числа.
Ненасыщенность жира зависит от присутствия в его составе непредельных жирных кислот. Ненасыщенные соединения легко присоединяют по 2 атома галогена по месту каждой двойной связи. Обычно степень ненасышенности определяется йодным числом. Йодное число измеряется количеством йода, которое присоединяется к 100 г жира. Йодное число позволяет судить о степени ненасыщенности жира, о склонности его к "высыханию", прогорканию и др.
Расчет: 1 мл 0,1 н раствора гипосульфита эквивалентен 1 мл 0,1 н раствора йода или 0,0127 г йода. Зная, сколько мл 0,1 н раствора гипосульфита пошло на титрование контроля и опыта, вычисляют йодное число:
Х= (A-B)f-0,0127*100
А - количество 0,1 н р-ра гипосульфита, затраченное на титрование контроля;
В - количество 0,1 н р-ра гипосульфита, затраченное на титрование пробы;
Г- коэффициент поправки на 0,1 н р-р гипосульфита;
С - навеска жира в г.
Определение числа омыления жира.
Числом омыления называется количество мг КОН, необходимого для нейтрализации всех свободных и связанных жирных кислот, содержащихся в 1 г жира.
Расчет: 1 мл 0,5 н раствора КОН соответствует 25 мг КОН. Количество КОН, которое пошло на нейтрализацию всех жирных кислот 1 г жира, равно:
С= ((B-A)Г25)/a
В - количество 0,5 н р-ра НС1, затраченное на титрование контроля;
А - количество 0,5 н р-ра НС1, затраченное на титрование пробы;
А - количество жира в граммах
Г- коэффициент поправки на 0,5 н р-р НС1.
Определение кислотного числа
Кислотным числом называется число мг КОН, необходимого для нейтрализации всех свободных жирных кислот в 1 г жира.
Расчет: Количество КОН в мг, которое пошло на титрование свободных жирных кислот в 1 г жира, равняется:
С=А Г 5,6
А - количество 0,1н р-ра КОН. затраченное на титрование пробы;
Г- коэффициент поправки на 0.1 н р-р КОН;
5,6 - количество мг КОН, содержащееся в 1 мл 0,1 н р-ра КОН.
Определение эфирного числа жира.
Эфирным числом называется количество КОН, необходимое для нейтрализации жирных кислот, которые образуются при омылении 1 г жира.
Это число определяют как разницу между числом омыления данного жира и его кислотным числом.
Э = число омыления – кислотное число
^
РАСПРЕДЕЛИТЕЛЬНАЯ ХРОМАТОГРАФИЯ АМИНОКИСЛОТ НА БУМАГЕ
Этот метод широко используется для разделения смеси аминокислот, длякачественного обнаружения отдельных аминокислот. Достоинством этого метода является то, что он позволяет исследовать ничтожное количество вещества.
Разделение аминокислот основано на их различной растворимости в нескольких несмешивающихся жидкостях (фазах). Одной из жидкостей служит вода, которая прочно ассоциируется с молекулами целлюлозы и образует неподвижную фазу. Менее полярные водонасыщенные органические растворители (изобутиловый, изопропиловый, бутиловый спирт, фенол и др.) составляют подвижную фазу. Подвижный органический растворитель поднимается по полоске бумаги, растворяет нанесенные на бумагу аминокислоты и увлекает их за собой. Скорость перемещения аминокислот на бумаге зависит от степени их растворимости в подвижных и неподвижных фазах. Чем больше растворимость аминокислот в водной фазе и чем меньше ее растворимость в неводной фазе, тем медленнее движется аминокислота по сравнению с фронтом органического растворителя. Иными словами, аминокислоты с объемными неполярными боковыми цепями (гли, лей, изо, фен, трп, вал, мет, тир), перемещаются быстрее, чем аминокислоты с более короткими боковыми цепями (про, ала, гли) или с полярными боковыми цепями (тре, глу, сер, арг, асп, гис, лиз, цис).
Положение отдельных аминокислот на хроматографической бумаге обнаруживают при помощи цветной реакции с нингидрином.
Идентификация отдельных аминокислот на хроматограмме проводят путем нанесения на ту же хроматограмму "свидетелей" - растворов отдельных аминокислот. Модно также идентифицировать аминокислоты по величине К.с равной отношению пути, пройденного аминокислотой (от места нанесения) (а) к расстоянию, пройденному растворителем (от места смеси аминокислот до фронта растворителя) (в)
Коэффициент Кс - величина, характерная для каждой аминокислоты и постоянная при данных условиях опыта (растворитель, температура, сорт бумаги).
Возможны разные варианты хроматографии на бумаге: нисходящая, восходящая, радиальная.
^ Ход по определению аминокислот с помощью радиальной хроматографии
1. Квадрат хромато графической фильтровальной бумаги размером 11х11 см делят диагоналями на 4 части. В центре пересечения диагоналей описывается окружность радиусом 10 –11 мм, стороны квадрата нумеруют. На середину каждой их четырех дуг, ограниченных диагоналями, наносят микропипеткой пятнышко (2-3 мм в диаметре) из аминокислот "свидетелей" и анализируемую смесь аминокислот (см. рисунок).

2. В центре квадрата иглой проделывают отверстие и в него вставляют фитиль, скатанный из небольшого треугольника фильтровальной бумаги в виде трубочки.
3. На дно чашки петри наливают 10-15 мл смеси растворителей (бутанол, уксусная кислота, вода) так, чтобы было покрыто дно чашки. Квадрат помещают на чашку Петри так, чтобы он лежал на ее краях. Фитилек должен касаться дна чашки Петри. Чашку Петри накрывают крышкой и оставляют при комнатной температуре. По фитильку растворитель поднимается вверх, распределяется по бумаге от центра к периферии листа. Когда фронт растворителя дойдет до краев чашки Петри (через 1 час), хроматограмму снимают, отмечают карандашом фронт растворителя, помещают ее на крышку чашки Петри и ставят в сушильный шкаф при температуре 100 - 130°С на 5 минут (до исчезновения запаха растворителя). Высушенную хроматограмму проявляют 0,2 % раствором нингидрина в ацетоне и вновь помещают в сушильный шкаф. Через несколько минут на хроматограмме появляются пятна, указывающие положение аминокислот.
4. Для каждой аминокислоты рассчитывают коэффициент распределения R f . Аминокислоты анализируемой смеси идентифицируют, сравнивая их с Rf аминокислоты - свидетеля.
Rтир = R1см =
Rглу = R2см =
Rлей = R3 см =
^ ОБЕССОЛИВАНИЕ БЕЛКОВОГО РАСТВОРА МЕТОДОМ
ГЕЛЬ-ФИЛЬТРАЦИИ
Низкомолекулярные вещества из белкового раствора можно достаточно быстро и полно уловить с помощью гель-фильтрации. Принцип, лежащий в основе этого метода, весьма прост. Хроматографическую колонку наполняют гелем, набухшим в воде или буферном растворе. Разделение веществ этим методом основано на различии в размерах молекул. Крупные молекулы не проникают в поры гранул геля и выходят из колонки в первую очередь, в то время как небольшие молекулы попадают через поры гранулы, вследствие чего задерживаются на колонке и движутся с меньшей скоростью. Метод гель-фильтрации часто называют разделением веществ по принцип молекулярного сита.
Свойствами молекулярного сита обладают многие пористые материалы. Наиболее часто для этих целей применяют органические полимеры с трехмерной структурой. Например, гели полисахарида декстрана (коммерческое название сефадексы). Существует несколько типов сефадексов, различающихся как размерами, так и количеством пор и величиной гранул. Это позволяет применять их для разделения веществ с разными размерами молекул. Благодаря высокому содержанию гидроксильных групп гранулы сефадекса легко набухают, образуя гель. Чем выше способность геля к набуханию, тем больше номер сефадекса. Для освобождения белковых растворов от солей обычно используют сефадекс марки 0-25.
^ Нанесение раствора белка. Перед нанесением раствора открывают кран на колонке и наблюдают за уменьшением столбика воды над слоем сеадекса. Как только над поверхностью геля остается слой жидкости толщиной 1-2 мм, кран закрывают и пипеткой аккуратно наносят на гель 1 мл белкового раствора, в который предварительно добавляют раствор К2СrО4 . Кран открывают и следят за проникновением раствора в гель. Снова закрывают кран, стенки колонки ополаскивают 1 мл дистиллированной воды, открывают кран и позволяют жидкости впитаться в гель. Затем кран закрывают, и, стараясь не взмучивать гель, аккуратно добавляют пипеткой по стенке 4-6 мл дистиллированной воды.
^ Сбор Фракций. В 8 пробирок отмеряют по 1 мл биуретового реактива. К колонке приливают воду и открывают кран. Собирают по 10 капель в пробирки, содержащие биуретовый реактив. Наблюдают изменение окраски в порциях элюата, содержащего белок(феолетовое окрашивание).
Выход хромата калия отмечают по появлению желтого окрашивания раствора в очередной пробирке.
Гель в колонке отмывают водой до полного удаления хромата калия. После этого колонка вновь готова к употреблению.
| № пробирки | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| белок | - | - | - | - | - | - | - |
|
| К2СгО4 | - | - | - | - | - |
Отсутствие окраски обозначают знаком "-", появление окраски - знаком " ", несколько знаков " " указывают на значительную интенсивность окраски. Выводы, полученные из результатов опыта, также заносят в протокол.
^ ДИАЛИЗ БЕЛКА
Диализом называется процесс разделения высокомолекулярных и низкомолекулярных веществ с помощью полупроницаемых мембран (коллодий, целлофан, пергамент и др.). Обладая большим диаметром, белковые молекулы не способны проникать через такие мембраны, в то время как частицы низкомолекулярных веществ легко проходят через них.
Ход работы:
1. В пробирку наливают 2 мл р-ра альбумина и прибавляют к раствору 1 каплю насыщенного р-ра сульфата аммония. Из листа целлофана, намоченного водой, делаю мешочек (диализатор) и выливают в него содержимое пробирки. Края мешочка зажимают между двумя стеклянными палочками, прижатыми друг к другу резиновыми колечками, надетыми на концы палочек. Мешочек помещают в стакан с дистиллированной водой, укладывают палочки на края стакана. Уровень жидкости в мешочке должен быть ниже жидкости в стакане.
2. Через 1 час от начала диализа берут в 2 пробирки по 1 мл жидкости из стакана и проделывают две реакции:
А) на присутствие SO4 добавляют в первую пробирку 3-4 капли 5 % р-ра ВаС12 и наблюдают образование осадка ВаS04 в виде белой мути.
Б) на присутствие белка: проделывают биуретовую реакцию. 3. Жидкость из мешочка сливают в пробирку (диализат), отмеряют 10 капель диализата и с ним тоже проделывают биуретовую реакцию.
Контрольные вопросы:
Опыт 2. Получение триброманилина.
Наличие аминогруппы в бензольном ядре резко повышает подвижность атомов водорода в орто- и пара-положении. Поэтому анилин, так же как и фенол, легко бромируется при комнатной температуре даже в разбавленных водных растворах.
Описание опыта . В пробирку налить 5 мл водного раствора анилина и прибавить по каплям бромную воду. Наблюдается обесцвечивание брома и выделение осадка труднорастворимого триброманилина. Уравнение реакции получения триброманилина:
Опыт 4. Диазотирование анилина.
Соли первичных ароматических аминов при действии на них азотистой кислоты образуют диазосоединения. Эта реакция носит название реакции диазотирования .
Ароматические диазосоединения могут быть двух типов: истинные диазосоединения строения Ar-N=N-X и соли диазония общей формулы X - . В солях диазония один атом азота трёхвалентный, а другой заряжен положительно и связан четырьмя ковалентными связями с атомом азота и ароматическим радикалом. Построенный таким образом ион диазония образует соль с анионом кислоты. Строение солей диазония имеют сходство их с солями аммония. Это сходство проявляется и в их свойствах. Соли диазония легко растворимы в воде. Их растворы нейтральны на лакмус.
Соли диазония имеют большое значение в органической химии, так как являются весьма реакционноспособными соединениями, с помощью которых можно получать многочисленные органические вещества.
Описание опыта. В пробирку наливают 1 мл анилина, 0,5 мл концентрированной соляной кислоты и кусочек льда. Пробирку с раствором помещают в воду со людом. В полученный раствор при встряхивании по каплям добавляют 0,5 мл охлаждённого раствора нитрита натрия (NaNO 2) . Получается фенилдиазоний. Уравнения реакций:
C 6 H 5 – NH 2 + HCl Cl
NaNO 2 + HCl HNO 2 + NaCl
0÷2 o C
+ -
Cl + HNO 2 Cl + 2H 2 O
Опыт 4. Получение анилина жёлтого.
Описание опыта . В пробирку налить 5 мл диметиланилина и добавить 5 мл воды. После того, как деметиланилин растворится в воде, добавить 10%-ный раствор соляной кислоты. Раствор охладить и добавить раствор из предыдущего опыта - фенилдиазоний. Затем к полученному раствору добавлять по каплям ацетат натрия до получения жёлтого осадка. Ацетат натрия добавляют для нейтрализации соляной кислоты. Уравнения реакций:
N=N
N
CH 3
Cl + C 6 H 5 N(CH 3) 2
CH 3 COONa + HCl CH 3 COOH + NaCl
| ● | Какие соединения называются аминами? Какова их классификация? |
| Почему амины обладают основными свойствами? |
|
| ● | Напишите уравнения реакций взаимодействия анилина, метиламина, аммиака с хлороводородом. Каковы их общие свойства? |
| ● | Какую реакцию можно считать качественной на анилин? |
| ● | Составьте структурные формулы всех аминов состава С 5 Н 13 N (без учёта аминов циклического строения) и назовите их. Сколько среди них вторичных и третичных аминов? |
| ● | Уравнением реакции (в структурной форме) объяснить обесцвечивание бромной воды и выпадение осадка белого цвета. Назвать вещество, образующее осадок |
| ● | Напишите реакцию взаимодействия метиламина с водой. Какова среда полученного раствора? |
| ● | Что наблюдаете при добавлении соляной и серной кислот к анилину? Напишите уравнения реакций и назовите полученные продукты. |
| ● | Напишите уравнение реакции диазотирования и назовите полученный продукт. |
| ● | Почему азосоединения окрашены? Какие функциональные группы могут служить в качестве ауксохрома и хромофора? |
ЛАБОРАТОРНАЯ РАБОТА №16
Тема: «Белки»
Аминокислотами называются азотсодержащие органические соединения, в молекулах которых содержатся аминогруппы и карбоксильные группы.
В зависимости от взаимного расположения карбоксильной и аминогрупп различают a-, β-, γ- и т.д. аминокислоты. Например,
Чаще всего термин "аминокислота" применяют для обозначения карбоновых кислот, аминогруппа которых находится в a- положении, т.е. для a- аминокислот. Общую формулу a- аминокислот можно представить следующим образом:
| H 2 N– | CH–COOH │ R |
В зависимости от природы радикала (R) – аминокислоты делятся на алифатические, ароматические и гетероциклические.
A-аминокислоты вступают друг с другом в реакцию поликонденсации, приводя к амидам кислот. Продукты такой конденсации называются пептидами. При взаимодействии двух аминокислот образуется дипептид:

Образующаяся группировка -СО-NH - называется пептидной связью.
При взаимодействии дипептида с новой молекулой аминокислоты получается трипептид и т.д.
Примеры простейших аминокислот
| Представитель | Н а з в а н и е |
|||
| систематическая номенклатура | рациональная номенклатура | тривиальная номенклатура |
||
| α | 2-амино Этановая Кислота | α-амино-уксусная кислота, гликокол | (гликокол) |
|
| α СH 3 – CH - COOH | 2-амино- пропановая кислота | α-амино-пропионовая кислота | ||
| β СH 2 - CH 2 - COOH | 3-амино- пропановая кислота | β-амино-пропионовая кислота | β-аланин |
|
| α СH 3 -CH 2 –CH- COOH | 2-амино- Бутановая | α-амино- Масляная кислота | ||
Белки – это азотсодержащие высокомолекулярные органические вещества со сложным составом и строением молекул. Представляют собой природные полимеры (сложные полипептиды), молекулы которых построены из остатков аминокислот, соединённых между собою амидной (пептидной) связью.
Это природные полипептиды с высокими значениями молекулярной массы (от 5-10 тыс. до 1 млн. и более). Они входят в состав клеток и тканей всех живых организмов и являются основной составной частью нашей пищи.
В состав белков входит углерод, водород, кислород и азот. В значительно меньшем количестве в их состав могут входить также сера, фосфор и другие элементы. Белки представляют собой весьма нестойкие соединения, что затрудняет изучение их физических и химических свойств. Конечными продуктами распада белков являются
α- аминокислоты. Молекулярная масса их очень велика.
С белками связаны все жизненные процессы. Они служат питательными веществами, регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д.
Опыт 1. Свёртывание белка при нагревании.
Свёртывание белков, т.е. денатурация – процесс утраты белком природной (нативной) конформации, сопровождающаяся обычно потерей его биологической функции. При денатурации под влиянием внешних факторов (температуры, механического воздействия, действия химических реагентов и ряда других факторов) происходит разрушение вторичной, третичной и четвертичной структур белковой макромолекулы. Первичная структура, а, следовательно, и химический состав белка не меняются. Изменяются физические свойства: снижается растворимость, способность к гидратации, теряется биологическая активность. Меняется форма белковой макромолекулы, происходит укрупнение.
Для работы служит белок куриного яйца, растворённый в воде (белок одного яйца на 150 мл воды).
Описание опыта . Небольшое количество раствора белка нагреть на горелке до кипения. Наблюдается помутнение жидкости. Полученный осадок не растворяется ни при охлаждении, ни при разбавлении водой, т.е. реакция является необратимой.
Опыт 2. Ксантопротеиновая реакция
Ксантопротеиновая реакция указывает на наличие в белках остатков ароматических аминокислот (фенилаланин, тирозин, триптофан). При действии концентрированной азотной кислоты происходит реакция нитрования ароматических ядер с образованием окрашенных в жёлтый цвет нитросоединений. При действии аммиака нитросоединения изомеризуются с образованием интенсивно окрашенных солеобразных продуктов.
Описание опыта . К 1 мл раствора белка добавить 5–6 капель концентрированной НNО 3 до появления белого осадка (или мути от свернувшегося под влиянием кислоты белка). При нагревании раствор и осадок окрасятся в ярко-желтый цвет (осадок почти полностью гидролизуется и растворится). Смесь охладить, добавить (осторожно, не взбалтывая) по каплям избыток концентрированного водного аммиака (или едкой щелочи) до щелочной реакции. Выпадающий сначала осадок кислотного альбумината растворится, жидкость окрасится в ярко-оранжевый цвет.

Опыт 3. Биуретовая реакция
Биуретовая реакция указывает на наличие в белке повторяющихся пептидных группировок –СО–NН–. Это подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щёлочи. Окраска объясняется образованием комплексных соединений меди.
Описание опыта . В пробирку помещают 1 мл раствора яичного белка, 1 мл раствора гидроксида натрия и 1–2 капли раствора сульфата меди (II). Жидкость окрасится в красно-фиолетовый цвет (при малом содержании белка к его раствору в щёлочи осторожно прибавить 0,5-1 мл раствора CuSO 4 , окраска появится на границе слоёв). Уравнение реакции:
CuSO 4 + 2NaOH → Na 2 SO 4 + Cu(OH) 2 ↓
2R – CH - COOH + Cu(OH) 2 → (R- CH-COO) 2 Cu + 2H 2 O
Опыт 4. Осаждение белка солями тяжёлых металлов
Описание опыта . Берут две пробирки и помещают в них по 1 мл раствора яичного белка и медленно, при встряхивании, по каплям, добавить в одну пробирку насыщенный раствор сульфата меди (II), в другую – 20%-ный раствор ацетата свинца. Образуются осадки трудно растворимых солеобразных соединений белка. Опыт иллюстрирует применение белка как противоядие при отравлении солями тяжёлых металлов. Уравнения реакций:
2R – CH - COOH + CuSO 4 → (R- CH-COO) 2 Cu + H 2 SO 4
2R–CH-COOH + (CH 3 COO) 2 Pb→ (R-CH-COO) 2 Pb + CH 3 COOН
Опыт 4. Открытие серы в белках
Описание опыта . В пробирку наливают около 0,5 мл раствора ацетата свинца и прибавляют раствор гидроксида калия до растворения образовавшегося осадка гидроксида свинца. В другую пробирку наливают около 2-3 мл раствора белка и приливают такой же объём полученного раствора плюмбита. Нагревают смесь до кипения в течение 2-3 минут. Появление тёмного окрашивания указывает на образование сульфита свинца. Напишите уравнения реакций.
Контрольные вопросы и упражнения:
| ● | Какие изменения происходят в структуре белка при нагревании? Меняется ли его первичная структура? |
| ● | Какие качественные реакции на белки Вы изучили? Какие структурные фрагменты белков они позволяют обнаружить |
| ● | Что происходит с белком при нагревании? Как называется этот процесс? |
| ● | Наличие каких функциональных групп, обуславливает взаимодействие белка с солями тяжёлых металлов? |
| ● | Напишите уравнение биуретовой реакции. На наличие какой группировки в белке указывает данная реакция? |
| ● | На наличие чего в белковых молекулах указывает ксантопротеиновая реакция. Напишите её уравнение. |
| ● | Аминокислота С 4 Н 9 О 2 N имеет пять структурных изомеров. Написать их структурные (сокращенные) формулы и назвать по рациональной и международной номенклатуре. |
Гарибян И.И. Учебно–методический комплекс по курсу «Органическая химия». Т., 2010, 309 С.
Жиряков В.Г. Органическая химия. - Л.: Химия. 1978
Петров А.А.,Бальян Х.Т.,Трощенко А.Т. Органическая химия.- М.:Высш.школа, 2005
http: // www. chem. net. ru
К Л Ю Ч Е В Ы Е С Л О В А
С О Д Е Р Ж А Н И Е
| 1. | Аннотация……..………………………………………………. | 2 |
| 2. | Введение……………………………………………………….. | 3 |
| 3. | Правила работы в лаборатории органической химии и предупредительные меры против несчастных случаев…..... | |
| 4 | Вопросы для коллоквиума по технике безопасности………. | 6 |
| 5. | Лабораторная работа 1. Элементный анализ органических соединений.……………………………………........................ | |
| 6. | Углеводороды…………………………………………………. | 11 |
| 7. | Лабораторная работа №2. Предельные углеводороды…….. | 13 |
| 8. | Лабораторная работа №3. Непредельные углеводороды (алкены)…………………………… ………………………...... | |
| 9. | Лабораторная работа №4. Непредельные углеводороды (алкины) ………..………………… ………………………...... | |
| 10. | Галоидопроизводные алифатических углеводородов……… | 23 |
| 11. | Лабораторная работа 5. Синтез этилбромида…………. ….... | 24 |
| 12. | Лабораторная работа 6. Ароматические углеводороды ….... | 25 |
| 13. | Кислородосодержащие органические соединения................ | 30 |
| 14 | Лабораторная работа 7. Спирты. …………..………………... | 30 |
| 15. | Лабораторная работа 8. Фенолы…………………………....... | 35 |
| 16. | Лабораторная работа 9. Альдегиды и кетоны…..................... | 39 |
| 17. | Лабораторная работа 10. Карбоновые кислоты……………. | 42 |
| 18. | Лабораторная работа 11. Оксикислоты……………………... | 47 |
| 19. | Лабораторная работа 12. Углеводы (моносахариды)…......... | 49 |
| 20. | Лабораторная работа 13. Дисахариды и полисахариды....... | 52 |
| 21. | Лабораторная работа 14. Синтез анилина…….…………...... | 55 |
| 22. | Лабораторная работа 15. Аминосоединения.……………...... | 56 |
| 23. | Лабораторная работа 16. Белки.......................……..………... | 59 |
| 24. | Литература…………………………………………………….. | 65 |
| 25. | Ключевые слова ……………..……………………………….. | 65 |
Качественные реакции на белки
Методы качественного обнаружения белков основаны на двух типах реакций: а) по пептидным связям белковой молекулы; б) по аминокислотным радикалам ее. Примером реакции первого типа служит биуретовая реакция. Примером реакций второго типа являются многочисленные цветные реакции на радикалы аминокислот (реакция Сакагучи - с α-нафтолом, реакция Паули - с нитритом калия, реакция Циммермана - с о-фталевым диальдегидом, нингидриновая реакция и др.)
Биуретовая реакция.
К 1-2 мл раствора белка прибавляют двойной объем 30%-ного раствора гидроксида натрия и хорошо перемешивают. Затем из капельницы добавляют несколько капель 1%-ного раствора сульфата меди и снова хорошо перемешивают. Развивается интенсивное красно - фиолетовое окрашивание, свидетельствующее о наличии пептидных, т.е. -СО-NH-, связей в молекуле белка. При малом содержании белка чувствительность реакции можно повысить, наслаивая на раствор белка в щелочи 1 мл 1%-ного раствора сульфата меди. При стоянии на границе двух слоев появляется фиолетовое кольцо.
Для сравнения проводят ту же реакцию с биуретом, который легко может быть получен при нагревании мочевины:
2 H 2 N-CO-NH 2 → +t → NH 3 + H 2 N-CO-NH-CO-NH 2
мочевина биурет
Для этого несколько кристаллов мочевины помещают в пробирку и осторожно прокаливают в пламени газовой горелки. По охлаждении приливают в пробирку 10%-ный раствор гидроксида натрия и добавляют несколько капель 1%-ного раствора сульфата меди. После перемешивания развивается сине-фиолетовая окраска.
И в том, и в другом случае окраска вызвана образованием комплексного соединения:
Биурет в щелочной среде претерпевает полную енолизацию по схеме:

Две молекулы диенольной формы биурета взаимодействуют с гидроксидом меди (II) и образуют комплексное соединение, в котором координационные связи образованы за счет электронных пар атомов азота иминных групп.
Аналогично построено комплексное соединение меди с енолизированными пептидными группами полипептида.

Комплексы такого типа обладают преимущественно красной окраской (максимум поглощения в пределах 520-530 нм). В случае образования медных комплексов при участии трех или двух атомов азота окраска их преимущественно фиолетовая и синяя (с максимумами поглощения в пределах 540-580 нм и 615-670 нм соответственно). Поэтому окраска растворов при проведении биуретовой реакции варьирирует от синей до красной с преобладанием фиолетовой.